Научные статьи о лечении подагры
Над статьей доктора
Шестернина А. С.
работали
литературный редактор
Елена Бережная,
научный редактор
Сергей Федосов
Дата публикации 6 декабря 2017Обновлено 22 июля 2019
Определение болезни. Причины заболевания
Подагра — системное заболевание, которое развивается в связи с воспалительным процессом, возникшим в месте отложения кристаллов моноурата натрия у людей с повышенным уровнем мочевой кислоты в сыворотке крови (более 360 мкмоль/л). Гиперурикемия возникает под воздействием как внешнесредовых, так и генетических факторов.
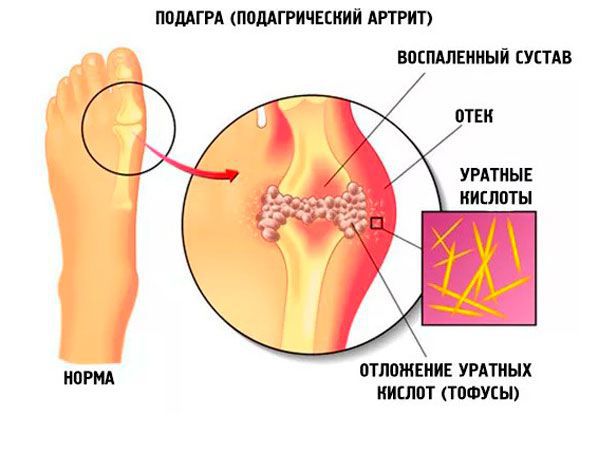
Заболеванию, как правило, подвержены мужчины, однако в последнее время оно выявляется и у слабого пола. Распространенность подагры растет, и это можно связать с ростом уровня жизни населения. Бессимптомная гиперурикемия встречается часто, однако далеко не всегда при этом развивается подагра.
На развитие подагры влияет:
- наследственность (предрасположенность к нарушению обмена пуринов);
- избыток в пище пуринов;
- нарушение функции почек, когда теряется их способность выводить мочевую кислоту (хроническая почечная недостаточность, поликистоз почек, гидронефроз, нефропатия в связи со злоупотреблением нестероидными противовоспалительными препаратами, при голодании);
- увеличение распада пуриновых нуклеотидов (цитостатическая терапия, лучевая и химиотерапия, хирургические вмешательства, гемолиз).[1][19]
Особенности современного течения подагры:
- значительный рост заболеваемости;
- увеличение частоты встречаемости у женщин;
- увеличение коморбидных состояний;
- начало заболевания в молодом возрасте.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением – это опасно для вашего здоровья!
Симптомы подагры
Подагра поражает опорно-двигательный аппарат и мочевыделительную систему. Возникает острый моноартрит, сопровождающийся нестерпимой, быстронарастающей и быстропроходящей за несколько часов или суток суставной болью, кожа над суставом краснеет, сам он увеличивается в объеме.
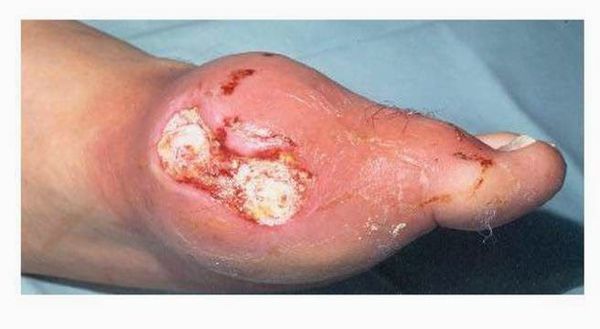
Из других симптомов — повышенная температура тела, слабость, потливость. При переходе в хроническую форму заболевания вокруг пораженных суставов образуются тофусы, суставы деформируются.
В почках образуются уратные камни, провоцируя тянущие боли в пояснице и периодическое появление крови в моче, никтурию (больше мочи выделяется ночью).[2][3]
Патогенез подагры
Поскольку образование уратов растет и нарушается выведение их почками, образуется избыток мочевой кислоты в крови, и происходит накопление уратов в тканях организма. Когда происходит отложение кристаллов моноурата в полости сустава, возникает воспалительный процесс из-за активации различных провоспалительных цитокинов. Кроме того, эти кристаллы откладываются в почечной ткани, приводя к развитию нефропатии и уратного нефролитиаза.[7]
Классификация и стадии развития подагры
3 стадии развития подагры:
- острый приступ подагрического артрита;
- межприступные периоды;
- хроническая тофусная подагра.[8]
Впервые подагрический приступ настигает пациента без предвестников, как правило, в возрасте от 40 до 50 лет, хотя известны случаи заболевания и в гораздо более молодом возрасте. Острая суставная боль, чаще в плюснефаланговом суставе большого пальца стопы (классический вариант начала), застает человека во второй половине ночи или в ранние утренние часы. Любое движение в суставе или прикосновение вызывает сильнейшую боль. Нарушение диеты, застолья с алкогольными напитками (алкоголь блокирует почку к выделению мочевой кислоты), хирургические вмешательства, инфекционные заболевания, повышенные нагрузки и травматизация сустава предшествуют возникновению приступа. Пациенты жалуются на покраснение пораженной области, ее припухание, сильную боль, общую слабость и недомогание, повышение температуры тела, потливость, разбитость, подавленность. Также характерными являются острые бурситы (препателлярный или локтевой сумки).[6]
В течение нескольких дней (около недели) приступ самостоятельно проходит. Именно из-за этого подагра часто создаёт видимость доброкачественности: всё проходит (особенно в начале) самостоятельно, и проблема забывается до следующего обострения. На самом деле подагра при таком подходе может привести к разрушению и деформации суставов, хронической болезни почек. Далее при отсутствии адекватного контроля над заболеванием приступы учащаются, перестают проходить самостоятельно, проходят за больший промежуток времени. Позже человек вообще перестает чувствовать себя здоровым, а находится в состоянии затянувшегося приступа. В результате этого над областью пораженных суставов образуются безболезненные подкожные узелки с крошковидным, творожистым содержимым – тофусы (соли мочевой кислоты беловатого или желтоватого цвета). Излюбленное место расположения тофусов – область суставов кистей и стоп, ахиллово сухожилие, ушные раковины, голеностопные и локтевые суставы. При хронической тофусной подагре происходит разрушение хряща, что грозит деформацией, полным разрушением сустава и его анкилозом (полное заращение и отсутствие движений). Иногда тофусы могут самостоятельно вскрываться, а из них выделяется густое содержимое.[9][17]
Осложнения подагры
- образование тофусов;
- формирование деформаций и анкилозов суставов;
- нефролитиаз (камни в почках);
- депрессия как следствие постоянного болевого синдрома;
- повышение артериального давления, ишемическая болезнь сердца. Гиперурикемия связана с повышенным риском смерти от болезней сердечно-сосудистой системы;
- статистически значимо при подагре гораздо более часто встречаются сопутствующие заболевания (артериальная гипертензия, сахарный диабет, атеросклероз, гипертриглицеридемия — метаболический синдром).[10]
Диагностика подагры
Диагностические критерии подагры Wallace (предложены ААР в 1975 году, одобрены ВОЗ в 2002 году):
- наличие кристаллов мочевой кислоты в суставной жидкости;
- наличие тофусов, содержание кристаллов мочевой кислоты в которых подтверждено химически или поляризационной микроскопией;
- наличие 6 из 12 следующих признаков:
- типичная картина острой суставной атаки (один и более раз) в анамнезе;
- признаки воспаления наиболее выражены в первые сутки;
- воспаление одного сустава (моноартрит);
- покраснение кожи над пораженным суставом;
- припухание и боль в первом плюснефаланговом суставе;
- поражение первого плюснефалангового сустава с одной стороны;
- поражение суставов стопы с одной стороны;
- тофусы и образования, напоминающие их;
- лабораторные изменения (повышение уровня мочевой кислоты в крови);
- несимметричный отек суставов;
- кисты под кортикальным слоем кости без эрозий на рентгенографии;
- стерильная синовиальная жидкость.[13]
При пункции врач получает синовиальную жидкость, в которой под микроскопом обнаруживаются кристаллы моноурата натрия. Они могут обнаруживаться и в тофусе. Диагноз при этом можно установить со стопроцентной вероятностью. Ураты выглядят как иглообразные кристаллы с одним утонченным концом. В отсутствие поляризационного микроскопа диагноз основывается в основном на типичных клинических проявлениях подагры. Острый артрит, болевые ощущения при котором нарастают лавинообразно, появляется отек и покраснение пораженного сустава, является веским поводом подумать о подагре. Рентгенологическое исследование суставов на ранней стадии болезни малоинформативно. Изменения выявляются на поздней стадии. В частности, симптом «пробойника» (субкортикальные кисты) — типичный рентгенологический признак подагры — полезен для диагностики ее тофусных форм. Также при рентгенографии при подагре отсутствует околосуставной остеопороз, редко видим сужение суставной щели, часто выявляется остеолиз.[11]
Дифференциальная диагностика:
- гнойный артрит;
- болезнь отложения кристаллов пирофосфата кальция дигидрата;
- ревматоидный артрит;
- реактивный артрит;
- псориатический артрит;
- остеоартроз.
Стоит обратить внимание на то, что во время приступа уровень содержания мочевой кислоты в крови может быть нормальным, так как она в этот момент усиленно выводится почками. На ее уровень в крови не следует ориентироваться при постановке диагноза.
Лечение подагры
Нелекарственные методы:
- соблюдение диеты;
- ограничение употребления алкоголя;
- уменьшение избыточного веса.
Диета при подагре является довольно строгой, но выполнение диетических рекомендаций является залогом успешного лечения. Продукты, которые богаты пуринами, подлежат исключению или минимизации. Обильное щелочное питье помогает почкам избавиться от избытка мочевой кислоты в крови (почки — единственный орган, выводящий мочевую кислоту).
Начнем с главного источника пуринов — птицы и мяса. Курица — один из самых вредных видов птицы. Курице немного уступают (содержат меньше пуринов) утка и гусь. Индейка замыкает список, обладая самым низким содержанием пуринов среди птицы. Говядина — лидер среди мясных продуктов по содержанию пуринов, далее идут телятина и свинина, баранина.
Что касается рыбы, то самые вредные — лососевые виды, далее шпроты, килька, сардины, треска. Морские обитатели, живущие в раковинах (устрицы), являются самыми богатыми на пурины. Субпродукты также очень вредны (мозги, печень, легкие, почки), так же, как и холодец, мясные бульоны и соусы. Колбасу (любую) стоит полностью исключить из рациона. Не рекомендуются также: грибы и грибные бульоны, бобовые, щавель, яйца, шоколад, дрожжи, рис полированный, инжир, геркулес, капуста цветная, дрожжи. Алкогольные напитки запрещены (особое внимание пиву, вину, шампанскому).
Объем употребляемой за сутки жидкости — 2-2,5 литра. Рекомендовано щелочное питье: щелочная минеральная вода, вода с добавлением лимона, соки.
Теперь о бедных пуринами продуктах — как раз о тех, которые необходимо есть. Ими являются: молоко и молочные, молочнокислые продукты, многие овощи (капуста белокочанная, картофель, огурцы, помидоры, морковь, лук), орехи, фрукты, мучные изделия, крупы, мед, масло сливочное. Отварное мясо и рыбу рекомендуется есть 2-3 раза в неделю. Можно есть сало, так как жир почти не содержит пуринов. Некоторые исследования свидетельствуют, что 1,5 литра кофе в день приравнивается к 100 мг аллопуринола, а таккже известно, что вишня и черешня обладают гипоурикемическим действием.[4][15]
Лекарственные методы
Лечение приступа подагры:
- колхицин и нестероидные противовоспалительные препараты — это первое, чем стоит лечить приступ подагры. Колхицин является растительным препаратом (производное безвременника). При приеме колхицина довольно часто возникают побочные эффекты (рвота, жидкий стул, сильный дискомфорт в животе, синдром мальабсорбции, геморрагический энтероколит, редко возникает миелосупрессия и гиперкоагуляция), поэтому стоит строго придерживаться рекомендуемых дозировок. Нестероидные противовоспалительные препараты (ацеклофенак, нимесулид, диклофенак, эторикоксиб) стоит принимать в максимальных терапевтических дозировках — меньшие могут быть неэффективны. Анальгетики при подагре неэффективны;
- глюкокортикоиды внутрисуставно, внутрь или парентерально, когда противопоказан колхицин, нестероидные противовоспалительные препараты или же лечение ими неэффективно. Эти препараты дают выраженный эффект, но должны быть назначены только врачом, злоупотребление глюкокортикоидами имеет необратимые последствия (развитие сахарного диабета, неконтролируемая артериальная гипертензия и т. д.);
- канакинумаб (Иларис) — моноклональные антитела к интерлейкину-1, используются у пациентов с частыми приступами (более трех приступов за последний год), которые не могут принимать колхицин и НПВП.[12][20]
Лечение хроничекого подагрического артрита
Чтобы успешно лечить хроническую подагру, нужно предупредить образование и растворить уже имеющиеся кристаллы моноурата натрия, а для этого необходимо поддерживать уровень мочевой кислоты ниже 360 мкмоль/л.
- аллопуринол — урикодепрессор, доза подбирается индивидуально с врачом. При почечной недостаточности доза подбирается под особым контролем. Аллопуринол подлежит отмене во время приступа;[18]
- фебуксостат (аденурик) — используется при неэффективности аллопуринола, выводится печенью, является альтернативой для лечения пациентов с патологией почек;
- бензбромарон — блокирует обратное всасывание мочевой кислоты в канальцах почек и способствует ее выведению через почки и кишечник;
- пеглотиказа — раствор ферментов, который расщепляет подагрические соли, в РФ не зарегистрирован, применятся только при тяжелом течении подагры;
- первое время, для исключения повторных приступов, можно использовать колхицин (0,5-1,0 грамм в сутки).[5][16]
Пациенты подлежат диспансерному наблюдению у врача-ревматолога. Врач определяет периодичность контроля анализов, меняет (увеличивает или уменьшает) дозы получаемых препаратов, занимается лечением приступа. Противоподагрические средства принимаются длительное время. Также к лечению сопутствующей патологии могут быть подключены смежные специалисты (кардиолог, эндокринолог, уролог, нефролог). Пациент может быть госпитализирован в ревматологическое отделение при длительном по времени приступе, неэффективном лечении на амбулаторном этапе, а также для подбора постоянной терапии.
Прогноз. Профилактика
Прогноз зависит от своевременности и успешности начатого лечения, приверженности пациента к лечению, соблюдения диетических рекомендаций. По большей части прогноз благоприятный, но он ухудшается при развитии поражения почек, которое может стать даже причиной смерти пациента.
Строгое соблюдение диеты является основным моментом в профилактике приступов подагры. Необходимо ограничить употребление алкоголя, не принимать некоторые лекарства (мочегонные препараты из группы тиазидов и петлевые мочегонные, неселективные бета-блокаторы, аспирин, никотиновую кислоту, леводопу). Если пациент худеет, то следует опасаться быстрой потери веса. Нужно стараться избегать обезвоживания и тяжелых физических нагрузок, воздействия низких температур. В профилактических целях аллопуринол может быть назначен только пациентам, страдающим онкологическими заболеваниями и получающим химиотерапию.[14]
Источник
Подагра – системное тофусное заболевание, характеризующееся отложением кристаллов моноурата натрия в различных тканях и развивающимся в связи с этим воспалением, у лиц с гиперурикемией (ГУ), обусловленной внешнесредовыми и/или генетическими факторами [1], одно из наиболее распространенных хронических заболеваний опорно–двигательного аппарата, особенно у мужчин среднего возраста.
По данным C.M. Harris с соавт., исследовавшим распространенность подагры в Англии, заболевание встречается в среднем у 1,64% мужчин и 0,29% женщин, непрерывно увеличиваясь с возрастом и достигая пика в возрасте старше 75 лет (5,3% мужчин и 2,8% женщин) [2]. Эпидемиологические данные свидетельствуют о непрерывном истинном росте заболеваемости подагрой в последние десятилетия, не обусловленном улучшением диагностики и приемом мочегонных препаратов [3]. Так, рядом работ показано, что заболеваемость подагрой за последние 10–20 лет возросла более чем вдвое [3,4]. Имеются данные и о снижении возраста дебюта подагры. При сравнении двух групп больных подагрой, диагностированной с 1983 г. по 1991 г. и с 1992 г. по 2000 г., возраст дебюта заболевания снизился почти на 3 года. Возросла частота женской и семейной подагры, нефролитиаза, а также некоторых характерных для больных подагрой коморбидных состояний – ожирения, гипертриглицеридемии и инсулинорезистентности [5].
Причины образования кристаллов, которые откладываются в виде депозитов различных размеров, называемых тофусами, до сих пор до конца не ясны. Небольшие тофусы обнаруживаются во многих органах и тканях уже в дебюте заболевания, а в случае хронического течения подагры постепенно формируются и крупные подкожные тофусы, обычно в области ушных раковин и суставов. Однако доказано, что главным фактором риска развития подагры является ГУ: вероятность развития подагры при сывороточном уровне мочевой кислоты (МК) >540 mмоль/л в 45 раз выше, чем у лиц с уровнем урикемии <420 mмоль/л [6]. Многократно увеличивают риск развития подагры и ГУ некоторые обменные нарушения, часто выявляемые у больных подагрой. Известно, что у большей части больных подагрой выявляются не только способствующие развитию и прогрессии атеросклероза отдельные метаболические нарушения, к которым прежде всего относят ожирение, нарушения углеводного и липидного обменов, повышение артериального давления; но и их комбинации, объединяемые термином «метаболический синдром» (МС). Применение рабочих критериев диагностики МС экспертов NCEP/ATP III при обследовании 312 больных подагрой в Институте ревматологии РАМН позволило выявить МС у 68% из них, сахарный диабет тип 2 (СД 2) выявлялся у 18%, артериальная гипертензия – у 83%, инсулинорезистентность – у 67%, перенесли инфаркт миокарда или инсульт 15% больных [7]. Результаты обследования более 8800 американцев в рамках исследовательской программы NHANES III показали, что частота МС у больных подагрой в разных возрастных группах в среднем более чем в 2 раза превышает таковую в популяции, достигая 65% в возрасте старше 60 лет [9]. Столь частое выявление не случайно, и уже сейчас можно утверждать, что именно МС во многом определяет клиническую картину заболевания. Установлено, что показатели, определяющие тяжесть течения подагры (частота приступов артрита, хроническое течение артрита, количество пораженных за время болезни суставов и выраженностью ГУ), ассоциируются с наличием как собственно МС, так и основных его составляющих (инсулинорезистентностью, ожирением, СД 2, нарушениями липидного обмена) [8,9]. Известно, что в нормальных концентрациях инсулин не влияет на выведение почками МК. Но в условиях свойственной инсулинорезистентности и МС гиперинсулинемии повышается реабсорбция натрия в проксимальных канальцах почек, приводя к активации уратно–ОН–каналов и, опосредованно, к увеличению реабсорбции уратов, способствуя, в конечном итоге, развитию ГУ и повышению АД [11]. Схожий механизм развития ГУ наблюдается при приеме мочегонных препаратов, ацетилсалициловой кислоты, злоупотреблении алкоголем. Исследование 36 больных подагрой с СД 2, проведенное в Институте ревматологии РАМН, показало, что при умеренной гипергликемии урикозурический эффект глюкозы нивелируется высоким уровнем инсулина у этих больных и сывороточный уровень МК остается высоким [11]. Динамические исследования неопровержимо свидетельствуют, что еще одним независимым фактором риска развития подагры у пациентов с асимптоматической ГУ является ожирение. При ожирении не только снижается почечная экскреция уратов, но в значительной мере возрастает и их продукция [12], увеличивая вероятность развития подагры более чем в три раза [13]. В несколько раз выше заболеваемость подагрой и у больных с нелеченной артериальной гипертензией [14].
«Золотым стандартом» диагностики подагры считается выявление кристаллов моноурата натрия при помощи поляризационной микроскопии или химическим методом в любых доступных для исследования средах (синовиальной жидкости, тофусе, синовиальной оболочке, слизистой оболочке желудка). В то же время идентификация кристаллов, несмотря на высокую чувствительность и специфичность, до сих пор не считается рутинным методом, требует от исследователя большого опыта, и при невозможности выявления кристаллов для диагностики подагры пользуются клиническими, рентгенологическими и лабораторными признаками, входящими в набор современных диагностических критериев подагры [15]. В этом случае диагноз вероятной подагры выставляется при наличии не менее 6 из 12 перечисленных ниже признаков (табл. 1).
Основным клиническим проявлением подагры является острый, начинающийся внезапно артрит, характеризующийся быстро нарастающей сильнейшей болью, гиперемией и гипертермией, протекающий в большинстве случаев по типу моноартрита. Более чем в половине случаев в дебюте заболевания поражается первый плюснефаланговый сустав, реже – суставы плюсны, коленный и голеностопный суставы. Провоцирующими факторами развития подагрической атаки могут являться травмы, переохлаждение, прием алкоголя, обильное потребление мяса и жирной пищи. Длительность приступов подагрического артрита, как правило, не превышает нескольких дней, значительно сокращаясь при приеме противовоспалительных средств. После атаки артрита наступает бессимптомный интервал, называемый межприступным периодом. Простота купирования первых приступов артрита и относительно длительные межприступные периоды в дебюте заболевания не должны вводить в заблуждение. Частота и длительность подагрических атак при отсутствии лечения постепенно увеличивается, межприступный период сокращается, вовлекаются новые суставы, эффективность противовоспалительных препаратов снижается, что при отсутствии адекватной терапии влечет за собой формирование тофусной формы заболевания и хронического течения артрита. Таким образом, цель лечения подагры заключается не только в быстром и безопасном купировании острого подагрического артрита, но должна быть направлена и на предотвращение рецидивов, развития хронической тофусной подагры.
Наиболее широко при терапии острого подагрического артрита используются нестероидные противовоспалительные препараты (НПВП), рекомендованные для применения с этой целью экспертами Европейской антиревматической лиги по диагностике и лечению подагры [16]. Использование НПВП более чем в 90% случаев приводит к полному купированию острого приступа артрита в течение 5–8 дней, причем, учитывая большую безопасность и, по некоторым данным, эффективность, применение селективных ЦОГ–2 ингибиторов может иметь преимущества перед неселективными НПВП [17]. Данные исследования, проведенного в ГУ Институт ревматологии РАМН и посвященного сравнению быстроты развития противовоспалительного и анальгетического эффектов различных НПВП при подагре, продемонстрировали большую эффективность использования у больных селективного ингибитора ЦОГ–2 нимесулида по сравнению с диклофенаком натрия; а сравнение гранулированной формы нимесулида (Нимесил®) с таблетированной показало превосходство первой [18]. Еще одним важным результатом этого исследования явился тот факт, что значительная положительная динамика в отношении боли и воспаления у больных, принимавших нимесулид, особенно в случае использования гранулированной формы препарата, прослеживалась даже в случае поражения нескольких суставов и при отсутствии эффекта от проводимой ранее терапии другими НПВП.
Не менее широко распространено в некоторых странах Европы применение колхицина, экстракта луковицы лугового шафрана (Colchicum autumnale). В последние годы пересматривается отношение к рекомендуемой с середины ХХ века схеме приема колхицина, основанной на назначении высоких доз препарата (по 0,5 мг каждые 1–2 ч, максимально до 6 мг за 12 ч) либо до наступления клинического эффекта, либо до появления побочных реакций (тошнота, рвота или диарея) [19]. Дело в том, что при сравнимой с НПВП эффективности для колхицина, помимо гастроэнтерологических осложнений, характерно частое развитие тяжелых побочных реакций, прежде всего поражения печени, острой почечной недостаточности и миелосупрессии. Предлагаются альтернативные схемы применения колхицина (по 0,5 мг 2–3 раза в сутки), отличающиеся хорошей эффективностью и переносимостью даже у больных со сниженной почечной функцией [20]. Тем не менее применение колхицина в настоящее время в США ограничено.
В случае неэффективности или наличия противопоказаний к применению НПВП и колхицина используют внутрисуставные инъекции глюкокортикоидов [21]. Однако необходимо помнить, что применение глюкокортикоидов при подагре (особенно внутривенное или внутримышечное введение препаратов) связывается с достаточно большим процентом ребаунд–синдрома (повторного обострения) и побочных эффектов, что требует нахождения больного в стационаре.
Считается обоснованным и параллельное использование для купирования острого приступа подагрического артрита фармакологических и нефармакологических методов лечения, в частности, локального применения криотерапии совместно с НПВП [17].
Основным методом терапии хронической тофусной подагры и профилактики приступов острых подагрических атак является назначение антигиперурикемических лекарственных препаратов (ингибиторы ксантиноксидазы – аллопуринол и пуринол; и урикозурические препараты) в комбинации с немедикаментозными методами лечения (диетотерапия, отказ от приема алкоголя, необоснованного применения диуретиков и низких доз салицилатов). Основной задачей терапии является достижение стойкой нормоурикемии – целевого сывороточного уровня МК ниже 360 мкмоль/л, минимизирующего вероятность развития подагрического артрита и предотвращающего формирование тофусов [17].
Большое значение для больных подагрой может иметь и адекватная коррекция отдельных метаболических нарушений. Например, соблюдение низкокалорийной диеты, как оказалось, имеет ряд преимуществ перед общепринятой при подагре низкопуриновой диетой, приводя к достоверному снижению сывороточного уровня МК уже в первые дни терапии, что может быть объяснено параллельным снижением уровня инсулина и выраженности ИР [22]. Рекомендованы к применению при подагре препараты, применяемые для лечения артериальной гипертензии (лозартан) и нарушений обмена липидов (фенофибрат), обладающие небольшим урикозурическим эффектом [17]. Назначение больным подагрой с нарушениями углеводного обмена метформина, в основе действия которого лежит способность к увеличению чувствительности тканей к инсулину, приводило к снижению сывороточного уровня МК в среднем на 22%, было отмечено уменьшение числа больных с хроническим артритом, количества пораженных на момент осмотра суставов и частоты приступов артрита [7,23].
Таким образом, своевременная диагностика, адекватная терапия подагры должны проводиться с учетом новых данных о патогенезе, клинических проявлениях и эпидемиологии подагры.
Литература
1. Насонова В.А., Барскова В.Г. Ранние диагностика и лечение подагры – научно обоснованное требование улучшения трудового и жизненного прогноза больных. Научно–практическая ревматология 2004; 1: 5–7.
2. Harris C.M., Lloyd D.C., Lewis J. The prevalence and prophylaxis of gout in England. J. Clin. Epidemiol. 1995, 48:1153–1158.
3. Arromdee E., Michet C.J., Crowson C.S. et al. Epidemiology of Gout: Is the Incidence Rising? J. Rheumatol. 2002, 29:2403–2406.
4. Wallace K.L., Riedel A.A., Joseph–Ridge N., Wortmann R. Increasing prevalence of gout and hyperuricemia over 10 years among older adult in a managed care population. J. Rheumatol. 2004; 31:1582–1587.
5. Chen S.Y., Chen C.L., Shen M.L. et al. Trends in the manifestations of gout in Taiwan. Rheumatology (Oxford). 2003; 42:1529–1533.
6. Campion E.W., Glynn R.J., DeLabry L.O. Asymptomatic hyperuricemia. Risks and consequences in the Normative Aging Study. Am. J. Med. 1987; 82:21–26.
7. Барскова В. Г. Метаболический синдром и кардиоваскулярные нарушения при подагре. Докторская диссертация. М., 2006, 291.
8. Choi H. K., Ford E. S., Li С., Curhan G. Prevalence of the Metabolic Syndrome in Patients With Gout: The Third National Health and Nutrition Examination Survey. Arthritis Rheum. 2007; 57: 109–115.
9. Eliseev M. S., Barskova V. G., Nassonova V. A., Nassonov E. L. Insulin resistance syndrome in patients with gout and its influence on uric acid concentration and severity of arthritis. Abstracts. Ann. Rheum. Dis. 2006; 65(Suppl II): 432.
10. Facchini F., Ida Chen Y. D., Hollenbeck C. B., Reaven G. M. Relationship between resistance to insulin mediated glucose uptake, urinary acid clearance and plasma uric acid concentration. JAMA 1991; 266:3008–3011.
11. Елисеев М.С., Барскова В.Г., Насонов Е.Л. и др. Особенности подагры, протекающей с сахарным диабетом 2 типа. Клин. Геронтология 2005; 4: 7–13.
12. Dessein P., Shipton E., Stanwix A. et al. Beneficial effects of weight loss associated with moderate calorie/carbohydrate restriction, and increased proportional intake of protein and unsaturated fat on serum urate and lipoprotein levels in gout: a pilot study. Ann. Rheum. Dis. 2000; 59: 539–543.
13. Choi H., Atkinson K., Karlson E., Curhan G. Obesity, weight change, hypertension, diuretic use, and risk of gout in men. Arch. Intern. Med. 2005; 165: 742–748.
14. Grodzicki T., Palmer A., Bulpitt C. J. Incidence of diabetes and gout in patients during 8 years of follow–up. The General Practice Hypertension Study Group. J. Hum. Hypertens. 1997; 11(9): 583–585.
15. Wallace S.L., Robinson H., Masi A.T. et al. Preliminary criteria for the classification of the acute arthritis of gout. Arthritis Rheum. 1977; 20:895–900.
16. Zhang W., Doherty M., Pascual–Gomez E. et al. EULAR evidence based recommendation for the diagnosis and management of gout. Ann. Rheum. Dis. 2005; 64(Suppl III):501.
17. Zhang W., Doherty M., Bardin T. et al. Clinical Studies Including Therapeutics (ESCISIT) EULAR Standing Committee For International Part II: Management. Report of a task force of the EULAR evidence based recommendations for gout. Ann. Rheum. Dis. 2006; 65:1312–1324.
18. Кудаева Ф.М., Елисеев М.С., Барскова В.Г., Насонова В.А. Сравнение скорости наступления анальгетического и противовоспалительного эффектов различных форм нимесулида и диклофенака натрия при подагрическом артрите. Тер. архив 2007; 5:35–40.
19. Hollander J.L. Arthritis and Allied Conditions: A Textbook of Rheumatology. 6th Edition. Philadelphia: Lea & Febiger; 1960.
20. Morris I., Varughese G., Mattingly P. Colchicine in acute gout. BMJ 2003, 327:1275–1276.
21. Fernandez C., Noguera R., Gonzalez J.A. et al. Treatment of acute attacks of gout with small doses of intraarticular triamcinolone acetonide. J. Rheumatol. 1999; 26:2285–2286.
22. Dessein P., Shipton E., Stanwix A. et al. Beneficial effects of weight loss associated with moderate calorie/carbohydrate restriction, and increased proportional intake of protein and unsaturated fat on serum urate and lipoprotein levels in gout: a pilot study. Ann. Rheum. Dis. 2000; 59: 539–543.
23. Eliseev M.S., Barskova V.G., Volkov A.V. et al. The efficacy and safety of metformin treatment in gouty patients with insulin resistence syndrome (pilot case control 6–months study). Ann. Rheum. Dis. 2005; 64(Suppl III):500.
Источник
