Менингит и пневмония у новорожденного
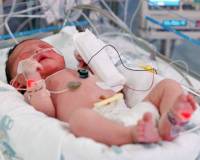
Пневмония у новорожденных — это острое инфекционно-воспалительное поражение респираторных отделов легких. Основные причины: возбудители TORCH-комплекса, стрептококки и стафилококки, хламидии, другие патогены, колонизирующие родовые пути матери. Заболевание проявляется синдромом дыхательных расстройств, инфекционным токсикозом, неврологическими нарушениями. Для диагностики неонатальных пневмоний проводят рентгенографию ОГК, бакпосев мокроты, серологические и общеклинические исследования крови. Лечение включает этиотропную антибиотикотерапию, кислородную поддержку, патогенетические медикаменты (иммуномодуляторы, инфузионные растворы).
Общие сведения
Пневмония — одна из основных проблем практической неонатологии. Заболеваемость составляет около 1% среди доношенных новорожденных и до 10% среди недоношенных. У младенцев, которые сразу после рождения находились на длительной ИВЛ, распространенность нозокомиальной пневмонии составляет до 40-45%. Воспаление легких рассматривается в качестве основной причины или сопутствующего фактора до 25% летальных исходов в период неонатальности. По данным Росстата, младенческая смертность от пневмонии достигает 7,5%.

Пневмония у новорожденных
Причины
У новорожденного собственный иммунитет крайне низкий, а все системы органов находятся в состоянии транзиторных приспособительных реакций и еще не адаптировались к смене условий после рождения. Поэтому младенцы очень чувствительны к любым видам инфекций, от которых преимущественно страдают кожа и респираторный тракт. Этиологическая структура неонатальных пневмоний отличается от таковой у старших детей и взрослых. Конкретные причины зависят от пути заражения:
- Трансплацентарный. В утробе матери ребенок чаще сталкивается с инфекциями TORCH-комплекса, которые имеют тропность к эпителию дыхательных путей, — с краснухой, токсоплазмозом, простым герпесом и цитомегаловирусом. В редких случаях происходит заражение сифилисом и туберкулезом.
- Интранатальный. Во время родов основной путь инфицирования — контактный, который реализуется при прохождении через материнские родовые пути. Если они не санированы, новорожденный может заразиться хламидиями, кишечной палочкой микоплазмой и уреаплазмой. Чаще других встречается хламидийная пневмония (33% случаев).
- Постнатальный. После рождения заражение младенца может произойти в стационаре, особенно, если ему проводят инвазивные манипуляции или кислородную поддержку. Здесь на первый план выходят золотистые стафилококки, синегнойная палочка, вирусы гриппа и парагриппа. Причины постнатальных пневмоний также включают грибы рода Кандида, аденовирусы, микобактерии туберкулеза.
Основной предрасполагающий фактор пневмонии у новорожденных — недоношенность, которая в 10 раз повышает риск заболевания. На втором месте стоят дыхательные нарушения, требующие интубации и применения ИВЛ. Частота пневмоний возрастает у детей с врожденными аномалиями дыхательных путей. Легочному воспалению способствует желудочно-пищеводный рефлюкс, при котором зачастую развивается аспирационный синдром и патогенные бактерии попадают в дыхательные пути.
Патогенез
В большинстве случаев при неонатальных пневмониях наблюдается двустороннее поражение интерстициальной ткани и альвеол, которое вызывает тяжелые гипоксические расстройства и связанный с ними ацидоз. Сочетание гипоксемии и нарушений кислотно-основного равновесия провоцирует полиорганную недостаточность. В первую очередь страдает сердечно-сосудистая система, а при тяжелом течении и другие органы — почки, печень, головной мозг.
Независимо от причины, пневмонии у новорожденных протекают в 3 стадии. Сначала происходит инфильтрация (первая неделя болезни), когда поражаются преимущественно периферические отделы легких. На второй неделе начинается стадия рассасывания, характеризующаяся уменьшением процента затемненных участков и повышением пневматизации. На третьей неделе наступает этап интерстициальных изменений и деформации легочного рисунка.
Классификация
В зависимости от причины, у новорожденных выделяют бактериальную, вирусную, грибковую или протозойную формы заболевания. Если патология возникла при отсутствии других очагов инфекции в организме, ее называют первичной. Вторичное воспаление легких формируется при аспирационном синдроме, сепсисе. В современной неонатологии важна классификация пневмоний по времени развития на 2 группы:
- Врожденные. Инфицирование в этом случае происходит анте- или интранатально, а первые клинические признаки определяются в течение 3 суток после родов. Частые причины врожденного воспаления — внутриутробные инфекции.
- Приобретенные (постнатальные). Заражение патогенными микробами происходит в роддоме (нозокомиальная форма) или после выписки младенца (внебольничная форма). Симптомы выявляются спустя 72 часа после рождения ребенка, но не позже 28 дня жизни.
Симптомы пневмонии у новорожденных
У новорожденных пневмонии преимущественно проявляются неспецифическими дыхательными расстройствами. Наблюдается частое и шумное дыхание, сопровождающееся «хрюкающими звуками». При этом крылья носа раздуваются, межреберные и надключичные промежутки втягиваются. Кожа вокруг рта и на кончиках пальцев синеет, при нарастании дыхательной недостаточности отмечается тотальный цианоз.
Кашель у новорожденного обычно отсутствует. Изо рта периодически выделяется слизь или пена с неприятным запахом. Симптоматика дополняется общими признаками: отказом от сосания груди, повышением температуры тела, патологической возбудимостью или угнетением ЦНС. В неонатальном периоде пневмониям сопутствует инфекционный токсикоз, для которого характерен серый оттенок кожи, геморрагическая сыпь, желтуха и гепатоспленомегалия.
Осложнения
Болезнь может приводить к отеку легких, гнойно-деструктивным процессам (абсцессам, буллам, гангрене), пиопневмотораксу. Продолжительные дыхательные расстройства у новорожденных провоцируют гипоксическую энцефалопатию, кардиопатию, нефропатию. Наиболее тяжело протекают пневмонии у недоношенных детей: они часто заканчиваются генерализацией инфекции и сепсисом, а в 40% вызывают летальный исход.
Диагностика
Неонатолог начинает обследование со сбора анамнеза матери (течение беременности и родов, экстрагенитальные патологии), чтобы предположить причины дыхательных нарушений у новорожденного. Физикальные данные малоинформативны, поскольку у младенцев намного труднее выявить хрипы и крепитацию при аускультации. Расстройства дыхания оценивают по шкале Сильвермана или Даунса. Основными диагностическими методами для верификации возможной пневмонии у новорожденных являются:
- Рентгенография ОГК. Основной метод, который показывает очаговые или тотальные затемнения в легких, состояние плевральных синусов, наличие признаков РДС по типу «матового стекла». На снимках врач может обнаружить врожденные пороки дыхательной системы, ставшие предрасполагающим фактором заболевания.
- Микробиологическое исследование. Для установления инфекционной причины пневмонии проводят бакпосев отделяемого из зева, мокроты или трахеобронхиального аспирата. Полученные микроорганизмы исследуют на чувствительность к антибиотикам. При подозрении на сепсис выполняется посев крови на стерильность.
- Серологические реакции. Определение антител к врожденным инфекциям (цитомегаловирус, краснуха) необходимо для выяснения характера пневмонии, если типичные возбудители исключены. При визуализации на рентгенографии признаков так называемой «белой» пневмонии назначают серологические тесты на сифилис (РСК, РИБТ).
- Анализы крови. Клиническое и биохимическое исследования рекомендованы для выявления маркеров воспалительной реакции, которые соотносятся с тяжестью и прогнозом болезни. Неблагоприятным считается высокий лейкоцитарный индекс интоксикации и возрастание уровня СРБ более 10 мг/л.
Лечение пневмонии у новорожденных
Консервативная терапия
Лечение младенцев с воспалением легких проводится только стационарно: в отделении патологии новорожденных или в блоке реанимации и интенсивной терапии. Основу лечения составляют антибиотики, которые сначала подбираются эмпирически, а затем корректируются после получения результатов бактериологической диагностики. В неонатологии в основном используют бета-лактамные препараты и макролиды. Как патогенетические методы применяются:
- Кислородная поддержка. Обеспечение нормальной сатурации — первостепенная задача врачей, поскольку это снижает риск метаболических и полиорганных нарушений. Рекомендована неинвазивная вентиляция (бифазик, CIPAP), в тяжелых случаях ребенка переводят на ИВЛ.
- Иммунотерапия. Для стимуляции собственных защитных сил организма новорожденного назначают иммуноглобулины II поколения, которые включают комплекс IgG, IgM, IgA (пентаглобин).
- Инфузионная терапия. Для восполнения ОЦК и коррекции электролитных показателей показано внутривенное вливание растворов. Базовым считается 10% раствор глюкозы, который обеспечивает организм энергией. При гипоксических нарушениях эффективно ведение неотона.
Прогноз и профилактика
Вероятность полного выздоровления высокая у доношенных новорожденных без врожденных пороков и иммунодефицитов. Менее благоприятнен прогноз у недоношенных младенцев, особенно когда они требуют кислородной поддержки на ИВЛ. Профилактика неонатальных пневмоний включает антенатальную охрану плода, своевременную диагностику и лечение инфекций у беременной, предотвращение РДС путем введения дексаметазона при высоком риске преждевременных родов.
Источник
Стрептококк группы В (S. agalactiae) является наиболее частой причиной заболеваемости и смертности новорожденных детей от менингита, сепсиса и пневмонии в развитых странах [1]. В США ежегодно заболевают тяжелой стрептококковой инфекцией группы В 8000 новорожденных, около 800 этих детей умирает. В Великобритании частота ранних неонатальных инфекций, вызванных стрептококком группы В (СГБ), составляет 3,6 случая на 1000 новорожденных [2]. Регистрация и профилактика СГБ-инфекции у беременных и новорожденных проводится во многих странах (США, Канада, Австралия, Бельгия, Франция и др.), что позволило радикально снизить частоту заболеваемости и летальность от данной инфекции у новорожденных. С введением в развитых странах антибиотикопрофилактики СГБ-инфекции в родах, частота развития менингита у детей в период с 1993 по 2008 год сократилась на 80 процентов [1]. В России мероприятия по регистрации и профилактике инфекций, вызванных СГБ, не проводятся.
Клинический случай. Ребенок (девочка) от первой беременности, протекавшей на фоне гестоза с 4-кратной угрозой прерывания. У матери во время беременности было обострение хронического пиелонефрита. Роды преждевременные на сроке 35–36 недель путем кесарева сечения. Масса тела при рождении 2650 г. Заболела в возрасте 24 дня: вялость, субфебрилитет, отказ от еды, срыгивания, жидкий стул 3–5 раз в день. На 4-й день болезни состояние резко ухудшилось, и девочка госпитализирована в инфекционный стационар. При поступлении состояние крайне тяжелое: среднемозговая кома, выбухание и пульсация большого родничка, частые приступы тонических судорог, дыхание аритимичное, ослабление дыхания в нижних отделах легких, мраморность кожи, акроцианоз, тахикардия до 190 уд./мин, «кофейная гуща» из желудка, олигурия. В общем анализе крови: Ley 21400, Tr 36000, п — 4%, с — 56%, э — 0%, б — 6%, л — 24%, м — 13%, t сверт. 9 мин, СОЭ 23 мм/ч. Результаты исследования ликвора: ликвор желтый, мутный, pH = 7,0, реакция Панди ++++, реакция Нонне-Апельта ++++, цитоз 34 тыс. клеток в 1 мкл (нейтрофилы 89%, лимфоциты 11%), белок 2,98 г/л, глюкоза 3,8 ммоль/л. В биохимическом анализе крови выявлена умеренная гипербилирубинемия и гиперферментемия, снижение протромбинового индекса (ПТИ) до 40%, декомпенсированный метаболический ацидоз (рН 6,8; ВЕ — 27,3 ммоль/л). Результаты бактериологического исследования крови и ликвора отрицательные. Положительный латекс-тест на антиген S. agalactiaе в ликворе. Исследования фекалий на ротавирус, патогенные и условно-патогенные микроорганизмы отрицательные. Заключительный диагноз: поздний неонатальный сепсис, вызванный S. agalactiae (менингоэнцефалит, кардит, энтероколит, пневмония, гепатит). Осложнения: полиорганная недостаточность. Септический шок II–III стадии. Отек-набухание головного мозга. Диссеминированное внутрисосудистое свертывание (ДВС-синдром) III стадии. Ребенок получил 4 курса антибактериальной терапии (ампициллин, цефтриаксон, меронем, амикацин, ванкомицин), посиндромную терапию. Выписана в удовлетворительном состоянии на 27-й день болезни.
Источник СГБ-инфекции и риск заболевания у ребенка
СГБ являются представителями нормальной микрофлоры урогенитального, кишечного тракта и верхних дыхательных путей человека. СГБ обнаруживаются в составе микрофлоры влагалища у 15–45% женщин [3]. Преобладает бессимптомная колонизация (носительство), но СГБ может стать причиной развития у женщины инфекции мочевых путей, сепсиса, хориоамнионита, эндометрита, тромбофлебита и эндокардита. Наиболее высок уровень колонизации у женщин моложе 20 лет, ведущих активную половую жизнь, использующих ВМС-контрацепцию [4]. Беременность не влияет на частоту носительства СГБ.
По нашим данным частота носительства S. agalactiaе в урогенитальном тракте у женщин репродуктивного возраста г. Казани составляет 12,7%. Результаты получены при бактериологическом исследовании мазков из цервикального канала, слизистой влагалища, мочи 172 женщин с использованием полихромогенной среды с последующей идентификацией микроорганизмов на анализаторе VITEK. Не исключается, что частота носительства СГБ выше, поскольку не проводилось бактериологическое исследование ректальных мазков.
Основным источником инфицирования новорожденных детей СГБ является мать [4]. Инфицирование ребенка может произойти внутриутробно, а также в родах. Родоразрешение путем кесарева сечения не снижает риск инфицирования ребенка СГБ. Вертикальный путь передачи СГБ в основном приводит к развитию ранней стрептококковой инфекции (срок развития до 7-го дня жизни). Основными факторами риска развития СГБ-инфекции у новорожденных являются: бактериурия S. agalactiae у матери во время беременности, неонатальные СГБ-инфекции у ранее рожденных детей, недоношенность (< 37 недель), лихорадка в родах, безводный период более 18 часов [6, 7]. Однако возможно развитие СГБ-инфекции у детей, рожденных матерями, не имеющими факторов риска. Риск инфицирования новорожденных при колонизации СГБ матери составляет 50%, при отсутствии стрептококков у матери — 8% [3]. Недоношенные дети со сроком гестации менее 35–37 недель имеют более высокий риск развития заболевания в связи с отсутствием у них специфических материнских антител. Риск заболевания у доношенных детей в общей популяции составляет около 0,2%, у недоношенных детей — 0,3% [8]. Частота клинической стрептококковой инфекции у новорожденных первых 7 дней жизни составляет 1,3–3:1000, родившихся живыми, после 7 дней жизни — 1–1,7:1000. На каждые 100 инфицированных новорожденных приходится 1 случай клинически явной инфекции. Возможно постнатальное инфицирование детей СГБ от матери, а также от медицинского персонала родильных отделений (частота носительства 16–47%) или от других новорожденных, что приводит к формированию поздней СГБ-инфекции (сроки развития 8 дней — 12 недель жизни [8]. Нозокомиальный риск инфицирования новорожденных СГБ при отсутствии инфекции у матери составляет 13–43% [8].
Исходя из когорты 16 000 новорожденных детей в год в Казани, установленного нами уровня колонизации беременных в 12,7%, установленного (по данным литературы) риска колонизации детей в 0,2% и частоты развития сепсиса 0,5/1000 можно ожидать развития от 8 до 15 случаев сепсиса в Казани в год. В 2010–2011 гг. в детских стационарах г. Казани диагностировано 4 случая СГБ-сепсиса и менингита у новорожденных и детей первых трех месяцев жизни, на фоне значительно более высокого числа случаев неонатального сепсиса и гнойных менингитов невыясненной этиологии.
Клинические проявления и исходы стрептококковой инфекции у новорожденных
У большинства новорожденных (99%), колонизированных СГБ, инфекционный процесс не развивается. У заболевших детей СГБ-инфекция в основном протекает в инвазивных формах: бактериемия, пневмония, менингит, сепсис. Инвазивная инфекция развивается только у той части новорожденных, которая постнатально колонизируется СГБ [8]. Имеются особенности течения и исходов ранней и поздней СГБ-инфекции новорожденных. Сепсис с ранним началом в 90% случаев развивается в течение 24 часов после рождения и в основном проявляется сепсисом (69%), пневмонией (26%), респираторным дистресс-синдромом (13%), реже — менингитом (11%) [9]. Ранние симптомы сепсиса неспецифичны и проявляются нарушением дыхания (апноэ, постанывание, тахи- и диспноэ) и нарушением перфузии кожи (сероватая бледность, мраморность), а также тахикардией и др. симптомами. Возможно развитие молниеносной формы инфекции с клиникой септического шока, респираторного дистресса и летальным исходом через несколько часов от начала заболевания. Сепсис с поздним началом (1–12 недель) в большинстве случаев проявляется менингитом (60%). В 20–30% случаев развитию менингита предшествуют симптомы поражения верхних дыхательных путей [9, 10]. Редкими проявлениями поздней СГБ-инфекции являются: отит, конъюнктивит, артрит, поражения кожи и остеомиелит [11]. Летальность от ранней СГБ инвазивной инфекции у доношенных составляет 2–10%, у недоношенных и маловесных при рождении детей — 30% [12]. У детей с поздней манифестацией СГБ-сепсиса летальность составляет 4–6% [9, 10, 13]. До 26% доношенных новорожденных с СГБ-менингитом умирают или имеют неврологические нарушения при выписке из стационара. В 50% случаев у выживших развивается глухота, гидроцефалия, судорожный синдром, моторные и сенсорные нарушения, задержка развития [14]. У недоношенных детей, переживших септический шок, может развиться перивентрикулярная лейкомаляция [15]. Рецидивы стрептококковой инфекции регистрируются даже после завершенного лечения в 1% случаев [8]. Риск неблагоприятного исхода стрептококкового менингита выше у детей, имевших: судороги, нарушение сознания, септический шок, содержание белка в спинномозговой жидкости ≥ 300 мг, содержание глюкозы < 20 мг/дл [15]. Риск неблагоприятного исхода у детей с ранним развитием менингита выше, чем у детей с поздним началом менингита (50% и 17%). Ученые предполагают, что частота неблагоприятных исходов стрептококкового менингита значительно выше, чем по данным литературы, поскольку выжившие дети могут иметь задержку в развитии или трудности в обучении в более старшем возрасте [14]. Фульминантность раннего сепсиса, а также незаметное постепенное начало позднего сепсиса делают жизненно необходимым умение быстрой постановки диагноза и диагноза-подозрения, а также проведения адекватной терапии [8].
Методы диагностики СГБ-инфекции
«Золотым» стандартом диагностики СГБ-инфекции является культуральный метод с использованием селективных сред (Тодда–Хевитта: бульон с кровью овец с добавлением налидиксовой кислоты и гентамицина). Диагностика инвазивных форм СГБ (сепсиса, менингита, пневмонии) основывается на выделении возбудителя из крови или ликвора или из других первично стерильных жидкостей организма. Однако диагностика заболевания, основанная только на культурах крови, не отражает истинную частоту встречаемости СГБ-сепсиса. Низкая (70%) чувствительность бактериологического метода исследования в диагностике инвазивных форм СГБ-инфекции у новорожденных детей связана с забором материала на фоне антибактериальной терапии, непостоянством бактериемии, низкой концентрацией возбудителя, небольшим объемом крови для исследования [8]. Так, чувствительность культурального метода при заборе крови на фоне антибактериальной терапии составляет всего 20–30%. Чувствительность бактериологического метода в диагностике СГБ-инфекции можно повысить на 20–30% при использовании селективных хромогенных сред.
Для диагностики СГБ-инфекции в настоящее время широко применяют экспресс-методы (полимеразная цепная реакция (ПЦР), латекс-агглютинация). Метод латекс-агглютинации имеет невысокую чувствительность (70%), поскольку минимально определяемая данным методом концентрация бактерий в спинномозговой жидкости составляет от 105 до 5 &s; 106 бактерий/мл [16]. ПЦР является незаменимым методом верификации инфекционных заболеваний в неонатологической практике [17]. Чувствительность, специфичность и прогностическая ценность (положительная и отрицательная) ПЦР по отношению к культуральному методу в диагностике СГБ-инфекции составляют соответственно 71%, 90%, 61%, 94% [8]. Женщинам, необследованным на сроке 35–37 недель и поступающим в клинику непосредственно перед родами, рекомендуется экспресс-диагностика (ПЦР или Strep-B-test). Иммунохроматографические полоски Strep B позволяют выявить возбудитель за 5–10 минут [18].
Лечение. СГБ сохраняют высокую чувствительностью к бета-лактамным антибиотикам. По результатам наших исследований, все штаммы S. agalactiae, выделенные из мочи и со слизистой влагалища женщин репродуктивного возраста, были чувствительны к пенициллину и другим бета-лактамам, ванкомицину. Устойчивость к тетрациклину выявлена в 20%, к эритромицину — в 18% случаев. Лечение СГБ-инфекции у новорожденных проводится пенициллином (300 000 МЕ/кг в сутки) или ампициллином (200 000 МЕ/кг в сутки), в комбинации с аминогликозидами (гентамицин, нетилмицин, амикацин). При менингите пенициллин следует назначать в дозе 500 000 МЕ/кг в сутки, ампициллин — 300 МЕ/кг в сутки. Цефалоспорины могут применяться, но они не обладают никакими преимуществами в сравнении с пенициллином или ампициллином. Рекомендуемая длительность терапии сепсиса 7–10 дней. При неинвазивных СГБ-инфекциях продолжительность монотерапии составляет не менее 10 суток, при СГБ-неосложненных менингитах — не менее 14 суток, при СГБ-артритах и остеомиелитах — 3–4 недели, при СГБ-эндокартите и СГБ-вентрикулите — не менее 4 недель. Лечение менингита должно продолжаться еще в течение 14 дней после санации ликвора в связи с возможностью рецидивов [19, 20].
Профилактика. Профилактика развития СГБ-инфекции у новорожденных основана на двух подходах — на учете факторов риска и скрининге беременных на инфекцию. При стратегии, «основанной на рисках», матери в родах получают антибиотики, когда присутствует один или несколько факторов: предыдущий ребенок с инвазивной инфекцией, вызванной СГБ, бактериурия при беременности, угроза преждевременных родов до 37 недель, высокая концентрация СГБ в урогенитальном тракте матери ко времени родоразрешения, промежуток времени между разрывом околоплодных оболочек и родоразрешением больше или равен 12 часам, лихорадка в родах более 38 °C [19, 21]. В основе стратегии профилактики, основанной на проведении скрининга, лежит положительная бактериальная культура ректовагинального мазка женщины, обследованной на сроке 35–37 недель беременности. Профилактика СГБ-инфекции, основанная на положительных результатах бактериологического обследования беременных женщин, более эффективна, чем профилактика, базирующаяся на факторах риска [1, 8]. Независимо от результата скрининга антибиотики назначаются, если имеется один из следующих факторов риска: предыдущий ребенок с инвазивной СГБ-инфекцией; бактериурия S. agalactiae; угроза преждевременных родов до 37 недель беременности. Химиопрофилактика женщине во время родов проводится путем в/в введения пенициллина: первая доза — 5 млн МЕ, затем по 2,5 млн МЕ каждые 4 часа до рождения ребенка. Можно применять ампициллин — стартовая доза 2 млн МЕ, затем по 1 млн МЕ каждые 4 часа до рождения ребенка. При аллергии на пенициллин применяют клиндамицин по 900 мг каждые 8 ч в/в до рождения или эритромицин 500 мг в/в каждые 6 ч до рождения.
Детям, рожденным инфицированными матерями, проводят бактериологическое исследование смывов из наружного слухового канала, слизистой зева, пупочной культи, паховых складок, а также мекония. Антибиотикотерапию проводят только детям с положительными результатами бактериологического обследования [22, 23]. Однако, по мнению немецких ученых, антибиотикопрофилактика у колонизированных новорожденных без клинических симптомов с целью предупреждения развития инвазивной инфекции не целесообразна [8]. Профилактическое назначение антибиотиков асимптоматичным детям (в том числе недоношенным), относящимся к группе риска по развитию СГБ-инфекции, также не показано, поскольку это не снижает риск заболевания и смерти по сравнению с детьми, получающими селективную антибиотикотерапию при выделении возбудителя [24, 25]. Следует отметить, что превентивное назначение антибиотиков матери не влияет на риск развития СГБ-менингита с поздним дебютом [14].
В настоящее время идет разработка иммуногенных поливалентных вакцин против полисахарид-белка СГБ. Конъюгированные вакцины завершили первую и вторую фазу испытаний у здоровых небеременных женщин, и результаты являются весьма перспективными [8].
Таким образом, несмотря на эффективные профилактические мероприятия, СГБ-инфекция у новорожденных и детей первых месяцев жизни остается заболеванием с высокой морбидностью. Имеются проблемы клинической и лабораторной диагностики СГБ-инфекции, в связи с чем этиологическую расшифровку данного заболевания необходимо проводить комплексно с использованием всех существующих на сегодняшний день методов исследования (бактериология, ПЦР, латекс-тест). В связи с высокой частотой колонизации S. agalactiae женщин репродуктивного возраста, продолжающейся регистрацией тяжелых случаев заболевания у новорожденных и детей первых месяцев жизни необходима разработка и внедрение национальной и региональных программ по регистрации и профилактике СГБ-инфекции у беременных и новорожденных.
Литература
- Apgar B. S., Greenberg G., Yen G. Prevention of group B streptococcal disease in the newborn. B // Am Fam Physician. 2005; 71 (5): 903–910.
- Luck S., Torny M., d’Agapeyeff K., Pitt A., Heath P., Breathnach A., Russell A. B. Estimated early-onset group B streptococcal neonatal disease // Lancet. 2003; 361: 1953–1954.
- Nandyal R. R. Up on group B streptococcal infections: perinatal and neonatal periods // J Perinat Neonatal Nurs. 2008; 22 (3): 230–237.
- Schuchat A., Zywicki S. S., Dinsmoor M. J. et al. Risk factors and opportunities for prevention of early-onset neonatal sepsis: a multicenter case-control study // Pediatrics. 2000; 105: 21–26.
- Law M. R., Palomaki G., Alfirevic Z. et al. The prevention of neonatal group B streptococcal disease: a report by a working group of the Medical Screening Society // J Med Screen. 2005; 12: 60–68.
- Zaleznik D. F., Rench M. A., Hillier S. et al. Invasive disease due to group B streptococcus in pregnant women and neonates from diverse population groups // Clin Infect Dis. 2000; 30: 276–281.
- Benitz W. E., Gould J. B., Druzin M. L. Risk factors for early-onset group B streptococcal sepsis: estimation of odds ratios by critical literature review // Pediatrics. 1999; 103: e77.
- Berner R. Infektionen durch Gruppe-B-Streptokokken In der Neonata lperiode // Monatsschr Kinderheild. 2003; 151: 373–383.
- Chung M. Y., Ko D. J., Chen C. C. et al. Neonatal group B streptococcal infection: a 7-year experience // Chang Gung Med J. 2004; 27: 501–508.
- Ho M. Y., Wu C. T., Huang F. Y. et al. Group B streptococcal infections in neonates: an 11-year review // Acta Paediatr Taiwan. 1999; 40: 83–86.
- Beal S., Dancer S. Antenatal prevention of neonatal group B streptococcal infection // Rev Gynaecol Perinatal Practice. 2006; 6: 218–225.
- Carlough M. C., Crowell K. How should we manage infants at risk for group B streptococcal disease? // J Fam Pract. 2003; 52: 406–409.
- Heath P. T., Balfour G., Weisner A. M. et al. Group B streptococcal disease in UK and Irish infants younger than 90 days // Lancet. 2004; 363: 292–294.
- Levent F., Baker C. J., Rench M. A., Edwards M. S. Early Outcomes of Group B Streptococcal Meningitis in the 21 st Century // Pediatr Infect Dis J. 2010; 29 (11): 1009–1012.
- Morven S. Edwards Prevention of Group B Streptococcal Disease: Answers to Questions Often Asked // Clinical Up in pediatric infectious diseases. 2000; Vol. 3, Issue 2.
- Платонов А. Е., Шипулин Г. А., Тютюнник Е. Н., Платонова О. В. Генодиагностика бактериальных менингитов и генотипирование их возбудителей: пособие для врачей. М., 2001. 29 с.
- Садова Н. В., Заплатников А. Л., Шипулина О. Ю. и др. Перинатальная инфекция, вызванная стрептококками группы В // РМЖ. 2010, № 1, с. 25–29.
- Cezarino B. N., Yamamoto L., Barbaro Del Negro G. M., Rocha D., Okay T. S. Diagnosis of neonatal group B Streptococcus sepsis by nested-PCR of residual urine samples // Brazilian Journal of Microbiology. 2008; 39: 21–24.
- Centers for Disease Control and prevention (CDC). Prevention of perinatal group В streptococcal disease: Revised Guidelines from CDC // Morb. Mortal. Wkly Rep. 2002; Vol. 51: 10–22.
- Red Book: Report of the Committee on Infectious Diseases. 27 h ed. Elk Grove Village, IL: American Academy of Pediatrics, 2006; 992.
- Schrag S., Gorwitz R., Fultz-Butts K., Schuchat A. Prevention of Perinatal Group B Streptococcal Disease. Revised Guidelines from CDC, 2002.
- Wiswell T. E., Baumgart S., Gannon C. M., Spitzer A. R. No lumbar puncture in the evaluation for early neonatal sepsis: will meningitis be missed? // P ediatrics, 1995, 95, 803–806.
- Шуляк Б. Ф. Инфекция стрептококка группы В, методы ее лабораторной диагностики и профилактики // Медицинский алфавит. 2010, № 2, с. 47–53.
- Ungerer R. L. S., Lincetto O., McGuire W. et al. Prophylactic versus selective antibiotics for term newborn infants of mothers with risk factors for neonatal infection. In: The Cochrane Library, Issue 2, 2010.
- Gerard P., Vergote-D’Hulst M., Bachy A. et al. Group B streptococcal colonization of pregnant women and their neonates. Epidemiological study and controlled trial of prophylactic treatment of the newborn // Acta Paediatr Scand. 1979; 68: 819–823.
И. В. Николаева, кандидат медицинских наук, доцент
Казанский государственный медицинский университет, Казань
Контактная информация об авторе для переписки: Irinanicolaeva@mail.ru
Источник
