Диагностика и лечение подагры современные методы
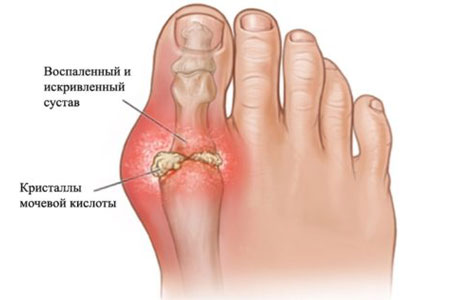
Подагра – хроническое заболевание, связанное с нарушением обмена мочевой кислоты, повышением содержания ее в крови и отложением в тканях кристаллов ее натриевой соли (уратов), что клинически проявляется рецидивирующим острым артритом и образованием подагрических узлов тофусов.
По МКБ-10 код подагры – М10.
Эпидемиология. В США и Европе страдают 2% жителей, причем среди мужчин в возрасте 55-64 лет подагрой болеют 4-6%.
В нашей стране подагра выявлена у 0,1% населения; вероятно, истинный процент выше, так как диагностируется подагра поздно.
Болеют чаще мужчины (5,5:1) в возрасте старше 40 лет, но встречается она и в молодом возрасте.
Заболеваемость подагрой во всем мире растет.
Этиология. Содержание мочевой кислоты в крови может повышаться под влиянием различных факторов, как внутренних, так и внешних.
Эти факторы способствуют либо увеличению образования эндогенных пуринов, либо замедлению их выделения почками. С этих позиций выделяют два типа гиперурикемии метаболический и почечный.
Метаболический тип характеризуется повышением синтеза эндогенных пуринов при наличии высокой ури козурии и нормальном клиренсе мочевой кислоты.
Напротив, при почечном типе наблюдается низкий клиренс мочевой кислоты и, следовательно, нарушение выделения мочевой кислоты почками. Представленные типы гиперурикемии имеют первостепенное значение в выборе противоподагрических модифицирующих болезнь препаратов, используемых в терапии этого заболевания.
Причины повышенного биосинтеза пуринов: наследственные факторы (снижение активности гипоксантин гуанин фосфорибозилтрансферазы; высокая активность фосфорибозилтрансферазы; дефицит глюкозо-6-фосфата); нозологические формы и клинические синдромы: усиление обмена нуклеотидов (истинная поли цитемия и вторичные эритроцитозы, острые и хронические лейкозы, лимфомы, гемолитическая анемия, гемоглобинопатии, лернициозная анемия и др.); опухоли; псориаз и псориатический артрит; системная красная волчанка, системная склеродермия: гипер паратиреоз; ожирение; болезнь Гоше; инфекционный мононуклеоз; гипоксия тканей; лекарства, диета и хронические интоксикации: этанол; диета с большим содержанием пуринов; фруктоза; никотиновая кислота; цитотоксические препараты; варфарин; этиламин 1,3,4 тиадиазол.
Причины замедления выведения мочевой кислоты почками: нозологические формы и клинические синдромы: хроническая почечная недостаточность; заболевания почек с преимущественно интерстициальными и канальцевыми нарушениями (поликистоз почек, анальгетическая нефропатия, гидронефроз); свинцовая нефропатия; обезвоживание; диабетический ке тоацидоз; гиперпродукция молочной кислоты; пре экламисия; ожирение; гиперпаратиреоз; гипотиреоз; саркоидоз; хроническая бериллиозная интоксикация; лекарства и хронические интоксикации: тиази довые диуретики; циклоспорин; низкие дозы салици латов; противотуберкулезные препараты (пиразина мид); этанол; леводопа.
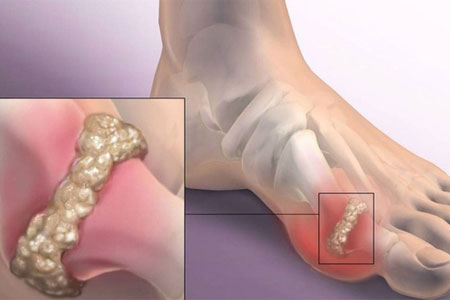
Патогенез. Длительная гиперурикемия возникает вследствие первичных нарушений обмена пуринов. Повышается выделение мочевой кислоты почками, что может привести к отложению уратов в тканях почек и возникновению различных патологических процессов. Гиперурикемия ведет к отложению мочевой кислоты в других тканях и суставах. Ураты натрия проникают в синовиальную жидкость, откладываются в сумках, сухожильных влагалищах. Урат натрия через хрящ проникает в эпифиз» в субхондральное пространство и там накапливается в виде конгломератов. Происходит атрофия костного вещества. В основе артрита лежит повреждение синовиальной оболочки кристаллами игольчатого вида, которые, проникая в нее, вызывают воспаление.
Кроме того, в синовиальной жидкости кристаллы уратов поглощаются нейтрофилами, которые фагоцитируют их.
Вследствие этого фагоцитоза возникает в конечном счете гибель нейтрофилов, выделяются лизосомальные ферменты, что запускает всю дальнейшую цепочку воспаления и повреждение синовиальной оболочки.
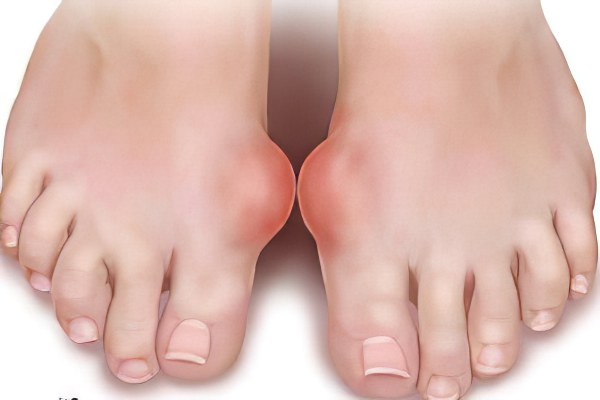
Клиническая картина. Наиболее типичное начало острый подагрический приступ. В классическом виде это поражение I плюснефалангового сустава. Вспышка острого артрита может быть спровоцирована приемом алкоголя (увеличивается гиперурикемия), травмой, инфекцией, стрессовым состоянием.
Может иметь значение нагрузка пищевыми продуктами, содержащими большое количество пуринов (печень, почки, телятина, молодая баранина).
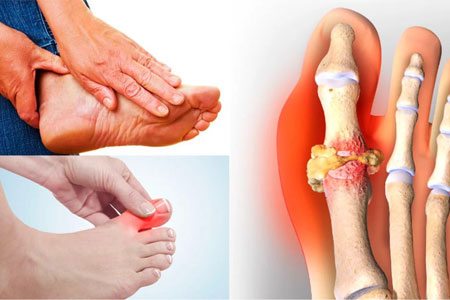
Приступ начинается внезапно, часто ночью, возникают резчайшие боли, иногда настолько сильные, что прикоснуться к суставу нельзя; сустав очень быстро отекает, становится синюшно багровым, функция его резко нарушается.
Приступ обычно длится недолго, но он для больного может быть очень тяжел по силе болевого ощущения. Через 2-3 дня боли резко уменьшаются. Приступы начинают повторяться, в процесс вовлекаются другие суставы, появляются отложения уратов (тофусы) на кистях рук, развивается полиартрит, включающий в себя не только плюснефалангоые суставы, но и крупные суставы (коленные, локтевые, плечевые).
Поражение крупного сустава вызывает реакцию окружающих тканей. Обычно при этом возникает отек, гиперемия кожи; так как в этих ситуациях у больного имеется высокая лихорадка и лейкоцитоз, все это вместе взятое напоминает картину флегмоны.
При подагре могут поражаться внутренние органы.
Особенно опасна подагрическая нефропатия, которая включает различные процессы (тофусы в паренхиме почек, уратные камни, ин терстициальный нефрит, гломерулосклероз, артериолосклероз с развитием нефросклероза), которые могут приводить к ХПН.
Диагностика. Рентгенологически типичными считаются «штампованные» дефекты эпифизов костей или крупные эрозии, разрушающие кортикальный слой кости, но во многих случаях они отсутствуют.
Лабораторные данные. Важнейшее гилеурикемия (выше 0,42 ммоль/л у мужчин и 0,36 ммоль/л у женщин).
Во время острого приступа выявляются лейкоцитоз и острофазовые реакции.
Критерии диагностики:
1) повышение содержания мочевой кислоты (выше 0,42 ммоль/л у мужчин и 0,36 ммоль/л у женшин);
2) тофусы;
3) кристаллы урата натрия в синовиальной жидкости;
4) острые приступы артрита, возникающие внезапно, с полной ремиссией в течение 1-2 нед.
Диагноз подагры устанавливается при наличии двух критериев.
Менее распространены диа диагностические критерии подагры, предложенные Американской коллегией ревматологов в 1977 г., которые скорее характеризуют острый воспалительный артрит или его рецидивирующие атаки, нежели подагру в целом.
Согласно этим критериям, достоверный диагноз ставится при наличии 6 из 12 признаков:
– более одной атаки острого артрита;
– развитие максимально острого воспалительного процесса в течение первых суток;
– моноартрит;
– покраснение кожи над пораженным суставом;
– боль или опухание первого плюснефалангового сустава;
– асимметричное поражение первого плюснефалангового сустава;
– асимметричное поражение суставов предплюсны;
– наличие образований, напоминающих тофусы;
– асимметричное опухание в пределах сустава (рентгенологический признак);
– субкортикальные кисты без эрозий;
– гиперурикемия;
– стерильная суставная жидкость.
Течение. Выделяют следующие варианты:
1) легкое, когда приступы артрита повторяются только 1-2 раза в год и захватывают не более двух суставов;
2) среднетяжелое, с частотой приступов 3-5 раз в год, с поражением двух четырех суставов, умеренно выраженной костно-суставной деструкцией, множественными крупными тофусами и наличием выраженной нефропатии.
Прогноз. В большинстве случаев подагра многие годы протекает легко.
В более тяжелых случаях (при массивных тофусах и разрушении суставов, при развитии подагрической нефропатии) в течение нескольких лет наступает инвалидизация больных.
Продолжительность жизни зависит от поражения почек и ССС.
Лечение. Диете при подагре придают наибольшее значение по сравнению с другими ревматическими болезнями.
Она предусматривает снижение общего калоража пищи, тем более что при подагре обычно наблюдается повышенная масса тела.
Необходимо уменьшить поступление в организм экзогенных пуринов и животных жиров.
Жиры снижают экскрецию мочевой кислоты почками.
Крайне осторожно следует подходить к употреблению любых алкогольных напитков, включая пиво и красное вино.
Исключают из пищевого рациона: печенку, почки, жирные сорта мяса, мясные бульоны, копчености, горох, бобы, чечевицу, шпинат, цветную капусту, шпроты, сельдь.
Следует ограничить потребление мяса до 2-3 раз в нед, при этом лучше употреблять его в отварном виде.
Сочетание строгой диеты с длительным применением противоподагрических препаратов, а также активное воздействие на заболевания, которые повышают содержание мочевой кислоты в крови, способны существенно замедлить темпы прогрессирования костно хрящевой деструкции, предупредить дальнейшее формирование тофусов и сохранить функциональное состояние опорно двигательного аппарата и почек.
При лечении острого приступа подагры наибольшим эффектом обладает колхицин – препарат, угнетающий миграцию лейкоцитов, затрудняющий фагоцитоз кристаллов уратов, задерживающий дегрануляцию лизосом. Препарат противопоказан при беременности, тяжелой почечной и печеночной недостаточности.
Побочные действия расстройства пищеварения (понос, рвота).
Назначается по 2 таблетки (в 1 таблетке 0,0005 г) каждые 2 ч.
2-й и 3-й дни 2 таблетки; 4-й день 1 таблетка вечером; следующие дни 1 таблетка вечером с ужином.
При хронической подагре – 1 таблетка вечером с ужином.
Ддя снятия острых болей – кеторол (мощный ненаркотический аналгетический препарат) в/м по 2 мл (30 мг) каждые 4-6 ч. Используются НПВП: бутадион (суточная доза до 800 мг, стандартно – 300-450 мг); индометацин (метиндол; суточная доза 450 мг); напроксен (суточная доза 750 мг), НПВП нового поколения (ингибиторы циклооксигеназы-2: нимесулид (найз) в таблетках по 100 мг 2 раза в сут до еды).
В тяжелых случаях можно воспользоваться ГКС, лучше введением преднизолона внутрь сустава (100 мг в крупный, 50 мг в средний и 25 мг в мелкий сустав).
После снятия острого приступа лечение продолжается длительно. Необходимо продолжать соблюдение диеты.
Препараты, непосредственно влияющие на обмен мочевой кислоты, оказывают урикодепрессивное либо урикозурическое действие.
Ингибиторы синтеза мочевой кислоты используют при метаболическом типе подагры с выраженной гиперурикемией (более 0,6 ммоль/л), с наличием тофусов, при уратной нефропатии (МКБ), вторичной подагре.
Основной препарат аллопуринол (милурит). Суточная доза 300-600 мг. Снижение уровня мочевой кислоты до нормы обычно происходит за 2-3 нед. Далее принимается поддерживающая доза (100-200 мг/сут).
Назначение аллопуринола чревато развитием нефротоксической реакции.
Урикозурические средства назначают при суточной экскреции мочевой кислоты менее 2,7 ммоль (менее 450 мг), при непереносимости аллопуринола.
Эти средства противопоказаны при метаболическом типе подагры, при малом объеме выделяемой мочи, при почечных камнях любого типа.
К препаратам данной группы относятся: пробенецид (бенемид) таблетки по 0,5 г; суточная доза 1,5 2г; препарат несовместим с салицилатами; сульфинпиразон (антуран) – суточная доза 400-600 мг; обладает дезагрегантным действием (полезно при сочетании подагры с атеросклерозом); кетазон таблетки по 0,25 г; эффективная доза – 1 г, поддерживающая – 0,25г, обычно 1 таблетка в сутки.
Существует препарат с комбинированным действием (ингибитор синтеза мочевой кислоты и урикозурическое средство) – алломарон: в 1 таблетке содержится 0,1 г аллопуринола и 0,02 г бензбромарона.
Суточная доза – 1 таблетка в день после еды, запивать небольшим количеством жидкости, в тяжелых случаях можно принимать до 3 таблеток в день.
При нефролитаазе необходимо поддерживать достаточный диурез (до 1,5 л).
Применяются плазмаферез, гемосорбция, хирургические методы удаления отложений мочевой кислоты в мягких тканях и артропластика.
Значительно облегчает самочувствие физиотерапия.
Составной частью комплексной терапии подагры являются ощелачивающие препараты и ощелачивающие растворы, которые способны снизить риск развития нефропатии и, в частности, мочекаменной болезни.
К этим препаратам относятся магурлит, блемарен и уралит.
Их применение должно регулярно контролироваться показателем рН мочи. Помимо этих средств, можно принимать питьевую соду 2-4 г в день или щелочные минеральные воды.
Профилактика. Актуальны выявление бессимптомной гиперурикемии у родственников больных подагрой и ее коррекция диетическими мероприятиями или при большой ее величине применение аллопуринола для предупреждения развития острого подагрического приступа.
Источник
. . – . : ” ?”.
?

, (, ) . , , . , 3 1000. 40 , . , .
, .
– , . .
: ()?
. ( ) , . , . .
: , , .
. , , (, , ) . , , , – , , , , .
, , . .
. , . . , :
. , , , .
– . , . , .
, , , . .
,
. , , . :
;
;
;
;
;
;
, ;
, .
,
, , . :
() , , .
.
( 3).
.
. . , 2015 . 47%. 27%. ().
, , , , . , , , , . , , – , . , .
, . , , , . . .
,
. , . , .
:
. , . . 30 , . , .
. . , . , . , , . ➤
. , , . . . , . , .
. , . . , , , . , , , , .
, . , , , .
, , .
, , . , , , , – , .
, .
. , . “” , . 39-40 °C. . . , , .
, , . , , , . .
. . . , . , , , . . .
, . , , .
– , , , . .
. . 40 . , 55, , , . . , .
. , . , . , , . , . .
, . , . , .
: , . , .
. : , , , .
, . , . , . :
. 0,42 /, 0,36 /.
, . .
. , , , , , .
?
. , . . , , .
. . , . , , , , , , ( ). . 3 ( ).
– . . , . : , , , . – , , .

, . . , , . .
, . . 6, . , , – . , , , , , . , , , , .
, , , , . , : , , , , , , . .
, ,
. , . , , . , , . -.
. . , . . , , – . .
. . , . , 2,5 .
, , , , . , .
. -. . , .
1-2 , , , , , .
, -2 ( 2) . () , . -2 , .
, , , , . .
:
;
.
, , . , , .
, 90% .
:
. , , . , , , , , , . , . , . : 80-100 30-50 ;
(, ) () , , , , , , . , , . . . 4500 7000 , -;
(Pegloticase, Krystexxa) , ( ). , . . , ;
(, ) , . , . ( ). , , . . , , , , , . , . 3500 7500 .

, , :
(, ) , . . , , ( ) . , . , , . , , . 1000 2000 ;
(, , , ) , , , . , , , . , , , . 30 ( ), 1500 ();
(, , , ) , . . , . , , , , , . , 10-30 , ( ) 150- .
?

, :
, 15-30 2-3 , ;
, ;
60 /;
: , , , , . . ;
. , , , . ;
, – . C;
, ;
, , 120 , .
:

, , . , , . , , , .
. , . .
, . , . , , .
, , . .
:

, , , . , .
, , Annals of the eumatic Diseases, , . , , , . , – , – , .
5927 , , , , . , 19% , , , . , , , , .
, , , . , .
?
-.
: | . . . -,
:
– (1996 .). 2003 – .
Источник
Подагра – системное тофусное заболевание, характеризующееся отложением кристаллов моноурата натрия в различных тканях и развивающимся в связи с этим воспалением, у лиц с гиперурикемией (ГУ), обусловленной внешнесредовыми и/или генетическими факторами [1], одно из наиболее распространенных хронических заболеваний опорно–двигательного аппарата, особенно у мужчин среднего возраста.
По данным C.M. Harris с соавт., исследовавшим распространенность подагры в Англии, заболевание встречается в среднем у 1,64% мужчин и 0,29% женщин, непрерывно увеличиваясь с возрастом и достигая пика в возрасте старше 75 лет (5,3% мужчин и 2,8% женщин) [2]. Эпидемиологические данные свидетельствуют о непрерывном истинном росте заболеваемости подагрой в последние десятилетия, не обусловленном улучшением диагностики и приемом мочегонных препаратов [3]. Так, рядом работ показано, что заболеваемость подагрой за последние 10–20 лет возросла более чем вдвое [3,4]. Имеются данные и о снижении возраста дебюта подагры. При сравнении двух групп больных подагрой, диагностированной с 1983 г. по 1991 г. и с 1992 г. по 2000 г., возраст дебюта заболевания снизился почти на 3 года. Возросла частота женской и семейной подагры, нефролитиаза, а также некоторых характерных для больных подагрой коморбидных состояний – ожирения, гипертриглицеридемии и инсулинорезистентности [5].
Причины образования кристаллов, которые откладываются в виде депозитов различных размеров, называемых тофусами, до сих пор до конца не ясны. Небольшие тофусы обнаруживаются во многих органах и тканях уже в дебюте заболевания, а в случае хронического течения подагры постепенно формируются и крупные подкожные тофусы, обычно в области ушных раковин и суставов. Однако доказано, что главным фактором риска развития подагры является ГУ: вероятность развития подагры при сывороточном уровне мочевой кислоты (МК) >540 mмоль/л в 45 раз выше, чем у лиц с уровнем урикемии <420 mмоль/л [6]. Многократно увеличивают риск развития подагры и ГУ некоторые обменные нарушения, часто выявляемые у больных подагрой. Известно, что у большей части больных подагрой выявляются не только способствующие развитию и прогрессии атеросклероза отдельные метаболические нарушения, к которым прежде всего относят ожирение, нарушения углеводного и липидного обменов, повышение артериального давления; но и их комбинации, объединяемые термином «метаболический синдром» (МС). Применение рабочих критериев диагностики МС экспертов NCEP/ATP III при обследовании 312 больных подагрой в Институте ревматологии РАМН позволило выявить МС у 68% из них, сахарный диабет тип 2 (СД 2) выявлялся у 18%, артериальная гипертензия – у 83%, инсулинорезистентность – у 67%, перенесли инфаркт миокарда или инсульт 15% больных [7]. Результаты обследования более 8800 американцев в рамках исследовательской программы NHANES III показали, что частота МС у больных подагрой в разных возрастных группах в среднем более чем в 2 раза превышает таковую в популяции, достигая 65% в возрасте старше 60 лет [9]. Столь частое выявление не случайно, и уже сейчас можно утверждать, что именно МС во многом определяет клиническую картину заболевания. Установлено, что показатели, определяющие тяжесть течения подагры (частота приступов артрита, хроническое течение артрита, количество пораженных за время болезни суставов и выраженностью ГУ), ассоциируются с наличием как собственно МС, так и основных его составляющих (инсулинорезистентностью, ожирением, СД 2, нарушениями липидного обмена) [8,9]. Известно, что в нормальных концентрациях инсулин не влияет на выведение почками МК. Но в условиях свойственной инсулинорезистентности и МС гиперинсулинемии повышается реабсорбция натрия в проксимальных канальцах почек, приводя к активации уратно–ОН–каналов и, опосредованно, к увеличению реабсорбции уратов, способствуя, в конечном итоге, развитию ГУ и повышению АД [11]. Схожий механизм развития ГУ наблюдается при приеме мочегонных препаратов, ацетилсалициловой кислоты, злоупотреблении алкоголем. Исследование 36 больных подагрой с СД 2, проведенное в Институте ревматологии РАМН, показало, что при умеренной гипергликемии урикозурический эффект глюкозы нивелируется высоким уровнем инсулина у этих больных и сывороточный уровень МК остается высоким [11]. Динамические исследования неопровержимо свидетельствуют, что еще одним независимым фактором риска развития подагры у пациентов с асимптоматической ГУ является ожирение. При ожирении не только снижается почечная экскреция уратов, но в значительной мере возрастает и их продукция [12], увеличивая вероятность развития подагры более чем в три раза [13]. В несколько раз выше заболеваемость подагрой и у больных с нелеченной артериальной гипертензией [14].
«Золотым стандартом» диагностики подагры считается выявление кристаллов моноурата натрия при помощи поляризационной микроскопии или химическим методом в любых доступных для исследования средах (синовиальной жидкости, тофусе, синовиальной оболочке, слизистой оболочке желудка). В то же время идентификация кристаллов, несмотря на высокую чувствительность и специфичность, до сих пор не считается рутинным методом, требует от исследователя большого опыта, и при невозможности выявления кристаллов для диагностики подагры пользуются клиническими, рентгенологическими и лабораторными признаками, входящими в набор современных диагностических критериев подагры [15]. В этом случае диагноз вероятной подагры выставляется при наличии не менее 6 из 12 перечисленных ниже признаков (табл. 1).
Основным клиническим проявлением подагры является острый, начинающийся внезапно артрит, характеризующийся быстро нарастающей сильнейшей болью, гиперемией и гипертермией, протекающий в большинстве случаев по типу моноартрита. Более чем в половине случаев в дебюте заболевания поражается первый плюснефаланговый сустав, реже – суставы плюсны, коленный и голеностопный суставы. Провоцирующими факторами развития подагрической атаки могут являться травмы, переохлаждение, прием алкоголя, обильное потребление мяса и жирной пищи. Длительность приступов подагрического артрита, как правило, не превышает нескольких дней, значительно сокращаясь при приеме противовоспалительных средств. После атаки артрита наступает бессимптомный интервал, называемый межприступным периодом. Простота купирования первых приступов артрита и относительно длительные межприступные периоды в дебюте заболевания не должны вводить в заблуждение. Частота и длительность подагрических атак при отсутствии лечения постепенно увеличивается, межприступный период сокращается, вовлекаются новые суставы, эффективность противовоспалительных препаратов снижается, что при отсутствии адекватной терапии влечет за собой формирование тофусной формы заболевания и хронического течения артрита. Таким образом, цель лечения подагры заключается не только в быстром и безопасном купировании острого подагрического артрита, но должна быть направлена и на предотвращение рецидивов, развития хронической тофусной подагры.
Наиболее широко при терапии острого подагрического артрита используются нестероидные противовоспалительные препараты (НПВП), рекомендованные для применения с этой целью экспертами Европейской антиревматической лиги по диагностике и лечению подагры [16]. Использование НПВП более чем в 90% случаев приводит к полному купированию острого приступа артрита в течение 5–8 дней, причем, учитывая большую безопасность и, по некоторым данным, эффективность, применение селективных ЦОГ–2 ингибиторов может иметь преимущества перед неселективными НПВП [17]. Данные исследования, проведенного в ГУ Институт ревматологии РАМН и посвященного сравнению быстроты развития противовоспалительного и анальгетического эффектов различных НПВП при подагре, продемонстрировали большую эффективность использования у больных селективного ингибитора ЦОГ–2 нимесулида по сравнению с диклофенаком натрия; а сравнение гранулированной формы нимесулида (Нимесил®) с таблетированной показало превосходство первой [18]. Еще одним важным результатом этого исследования явился тот факт, что значительная положительная динамика в отношении боли и воспаления у больных, принимавших нимесулид, особенно в случае использования гранулированной формы препарата, прослеживалась даже в случае поражения нескольких суставов и при отсутствии эффекта от проводимой ранее терапии другими НПВП.
Не менее широко распространено в некоторых странах Европы применение колхицина, экстракта луковицы лугового шафрана (Colchicum autumnale). В последние годы пересматривается отношение к рекомендуемой с середины ХХ века схеме приема колхицина, основанной на назначении высоких доз препарата (по 0,5 мг каждые 1–2 ч, максимально до 6 мг за 12 ч) либо до наступления клинического эффекта, либо до появления побочных реакций (тошнота, рвота или диарея) [19]. Дело в том, что при сравнимой с НПВП эффективности для колхицина, помимо гастроэнтерологических осложнений, характерно частое развитие тяжелых побочных реакций, прежде всего поражения печени, острой почечной недостаточности и миелосупрессии. Предлагаются альтернативные схемы применения колхицина (по 0,5 мг 2–3 раза в сутки), отличающиеся хорошей эффективностью и переносимостью даже у больных со сниженной почечной функцией [20]. Тем не менее применение колхицина в настоящее время в США ограничено.
В случае неэффективности или наличия противопоказаний к применению НПВП и колхицина используют внутрисуставные инъекции глюкокортикоидов [21]. Однако необходимо помнить, что применение глюкокортикоидов при подагре (особенно внутривенное или внутримышечное введение препаратов) связывается с достаточно большим процентом ребаунд–синдрома (повторного обострения) и побочных эффектов, что требует нахождения больного в стационаре.
Считается обоснованным и параллельное использование для купирования острого приступа подагрического артрита фармакологических и нефармакологических методов лечения, в частности, локального применения криотерапии совместно с НПВП [17].
Основным методом терапии хронической тофусной подагры и профилактики приступов острых подагрических атак является назначение антигиперурикемических лекарственных препаратов (ингибиторы ксантиноксидазы – аллопуринол и пуринол; и урикозурические препараты) в комбинации с немедикаментозными методами лечения (диетотерапия, отказ от приема алкоголя, необоснованного применения диуретиков и низких доз салицилатов). Основной задачей терапии является достижение стойкой нормоурикемии – целевого сывороточного уровня МК ниже 360 мкмоль/л, минимизирующего вероятность развития подагрического артрита и предотвращающего формирование тофусов [17].
Большое значение для больных подагрой может иметь и адекватная коррекция отдельных метаболических нарушений. Например, соблюдение низкокалорийной диеты, как оказалось, имеет ряд преимуществ перед общепринятой при подагре низкопуриновой диетой, приводя к достоверному снижению сывороточного уровня МК уже в первые дни терапии, что может быть объяснено параллельным снижением уровня инсулина и выраженности ИР [22]. Рекомендованы к применению при подагре препараты, применяемые для лечения артериальной гипертензии (лозартан) и нарушений обмена липидов (фенофибрат), обладающие небольшим урикозурическим эффектом [17]. Назначение больным подагрой с нарушениями углеводного обмена метформина, в основе действия которого лежит способность к увеличению чувствительности тканей к инсулину, приводило к снижению сывороточного уровня МК в среднем на 22%, было отмечено уменьшение числа больных с хроническим артритом, количества пораженных на момент осмотра суставов и частоты приступов артрита [7,23].
Таким образом, своевременная диагностика, адекватная терапия подагры должны проводиться с учетом новых данных о патогенезе, клинических проявлениях и эпидемиологии подагры.
Литература
1. Насонова В.А., Барскова В.Г. Ранние диагностика и лечение подагры – научно обоснованное требование улучшения трудового и жизненного прогноза больных. Научно–практическая ревматология 2004; 1: 5–7.
2. Harris C.M., Lloyd D.C., Lewis J. The prevalence and prophylaxis of gout in England. J. Clin. Epidemiol. 1995, 48:1153–1158.
3. Arromdee E., Michet C.J., Crowson C.S. et al. Epidemiology of Gout: Is the Incidence Rising? J. Rheumatol. 2002, 29:2403–2406.
4. Wallace K.L., Riedel A.A., Joseph–Ridge N., Wortmann R. Increasing prevalence of gout and hyperuricemia over 10 years among older adult in a managed care population. J. Rheumatol. 2004; 31:1582–1587.
5. Chen S.Y., Chen C.L., Shen M.L. et al. Trends in the manifestations of gout in Taiwan. Rheumatology (Oxford). 2003; 42:1529–1533.
6. Campion E.W., Glynn R.J., DeLabry L.O. Asymptomatic hyperuricemia. Risks and consequences in the Normative Aging Study. Am. J. Med. 1987; 82:21–26.
7. Барскова В. Г. Метаболический синдром и кардиоваскулярные нарушения при подагре. Докторская диссертация. М., 2006, 291.
8. Choi H. K., Ford E. S., Li С., Curhan G. Prevalence of the Metabolic Syndrome in Patients With Gout: The Third National Health and Nutrition Examination Survey. Arthritis Rheum. 2007; 57: 109–115.
9. Eliseev M. S., Barskova V. G., Nassonova V. A., Nassonov E. L. Insulin resistance syndrome in patients with gout and its influence on uric acid concentration and severity of arthritis. Abstracts. Ann. Rheum. Dis. 2006; 65(Suppl II): 432.
10. Facchini F., Ida Chen Y. D., Hollenbeck C. B., Reaven G. M. Relationship between resistance to insulin mediated glucose uptake, urinary acid clearance and plasma uric acid concentration. JAMA 1991; 266:3008–3011.
11. Елисеев М.С., Барскова В.Г., Насонов Е.Л. и др. Особенности подагры, протекающей с сахарным диабетом 2 типа. Клин. Геронтология 2005; 4: 7–13.
12. Dessein P., Shipton E., Stanwix A. et al. Beneficial effects of weight loss associated with moderate calorie/carbohydrate restriction, and increased proportional intake of protein and unsaturated fat on serum urate and lipoprotein levels in gout: a pilot study. Ann. Rheum. Dis. 2000; 59: 539–543.
13. Choi H., Atkinson K., Karlson E., Curhan G. Obesity, weight change, hypertension, diuretic use, and risk of gout in men. Arch. Intern. Med. 2005; 165: 742–748.
14. Grodzicki T., Palmer A., Bulpitt C. J. Incidence of diabetes and gout in patients during 8 years of follow–up. The General Practice Hypertension Study Group. J. Hum. Hypertens. 1997; 11(9): 583–585.
15. Wallace S.L., Robinson H., Masi A.T. et al. Preliminary criteria for the classification of the acute arthritis of gout. Arthritis Rheum. 1977; 20:895–900.
16. Zhang W., Doherty M., Pascual–Gomez E. et al. EULAR evidence based recommendation for the diagnosis and management of gout. Ann. Rheum. Dis. 2005; 64(Suppl III):501.
17. Zhang W., Doherty M., Bardin T. et al. Clinical Studies Including Therapeutics (ESCISIT) EULAR Standing Committee For International Part II: Management. Report of a task force of the EULAR evidence based recommendations for gout. Ann. Rheum. Dis. 2006; 65:1312–1324.
18. Кудаева Ф.М., Елисеев М.С., Барскова В.Г., Насонова В.А. Сравнение скорости наступления анальгетического и противовоспалительного эффектов различных форм нимесулида и диклофенака натрия при подагрическом артрите. Тер. архив 2007; 5:35–40.
19. Hollander J.L. Arthritis and Allied Conditions: A Textbook of Rheumatology. 6th Edition. Philadelphia: Lea & Febiger; 1960.
20. Morris I., Varughese G., Mattingly P. Colchicine in acute gout. BMJ 2003, 327:1275–1276.
21. Fernandez C., Noguera R., Gonzalez J.A. et al. Treatment of acute attacks of gout with small doses of intraarticular triamcinolone acetonide. J. Rheumatol. 1999; 26:2285–2286.
22. Dessein P., Shipton E., Stanwix A. et al. Beneficial effects of weight loss associated with moderate calorie/carbohydrate restriction, and increased proportional intake of protein and unsaturated fat on serum urate and lipoprotein levels in gout: a pilot study. Ann. Rheum. Dis. 2000; 59: 539–543.
23. Eliseev M.S., Barskova V.G., Volkov A.V. et al. The efficacy and safety of metformin treatment in gouty patients with insulin resistence syndrome (pilot case control 6–months study). Ann. Rheum. Dis. 2005; 64(Suppl III):500.
Источник
