Сколько дней колят антибиотики при пневмонии у новорожденного
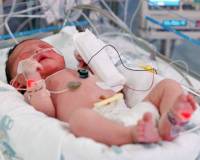
Пневмония у новорожденных — это острое инфекционно-воспалительное поражение респираторных отделов легких. Основные причины: возбудители TORCH-комплекса, стрептококки и стафилококки, хламидии, другие патогены, колонизирующие родовые пути матери. Заболевание проявляется синдромом дыхательных расстройств, инфекционным токсикозом, неврологическими нарушениями. Для диагностики неонатальных пневмоний проводят рентгенографию ОГК, бакпосев мокроты, серологические и общеклинические исследования крови. Лечение включает этиотропную антибиотикотерапию, кислородную поддержку, патогенетические медикаменты (иммуномодуляторы, инфузионные растворы).
Общие сведения
Пневмония — одна из основных проблем практической неонатологии. Заболеваемость составляет около 1% среди доношенных новорожденных и до 10% среди недоношенных. У младенцев, которые сразу после рождения находились на длительной ИВЛ, распространенность нозокомиальной пневмонии составляет до 40-45%. Воспаление легких рассматривается в качестве основной причины или сопутствующего фактора до 25% летальных исходов в период неонатальности. По данным Росстата, младенческая смертность от пневмонии достигает 7,5%.

Пневмония у новорожденных
Причины
У новорожденного собственный иммунитет крайне низкий, а все системы органов находятся в состоянии транзиторных приспособительных реакций и еще не адаптировались к смене условий после рождения. Поэтому младенцы очень чувствительны к любым видам инфекций, от которых преимущественно страдают кожа и респираторный тракт. Этиологическая структура неонатальных пневмоний отличается от таковой у старших детей и взрослых. Конкретные причины зависят от пути заражения:
- Трансплацентарный. В утробе матери ребенок чаще сталкивается с инфекциями TORCH-комплекса, которые имеют тропность к эпителию дыхательных путей, — с краснухой, токсоплазмозом, простым герпесом и цитомегаловирусом. В редких случаях происходит заражение сифилисом и туберкулезом.
- Интранатальный. Во время родов основной путь инфицирования — контактный, который реализуется при прохождении через материнские родовые пути. Если они не санированы, новорожденный может заразиться хламидиями, кишечной палочкой микоплазмой и уреаплазмой. Чаще других встречается хламидийная пневмония (33% случаев).
- Постнатальный. После рождения заражение младенца может произойти в стационаре, особенно, если ему проводят инвазивные манипуляции или кислородную поддержку. Здесь на первый план выходят золотистые стафилококки, синегнойная палочка, вирусы гриппа и парагриппа. Причины постнатальных пневмоний также включают грибы рода Кандида, аденовирусы, микобактерии туберкулеза.
Основной предрасполагающий фактор пневмонии у новорожденных — недоношенность, которая в 10 раз повышает риск заболевания. На втором месте стоят дыхательные нарушения, требующие интубации и применения ИВЛ. Частота пневмоний возрастает у детей с врожденными аномалиями дыхательных путей. Легочному воспалению способствует желудочно-пищеводный рефлюкс, при котором зачастую развивается аспирационный синдром и патогенные бактерии попадают в дыхательные пути.
Патогенез
В большинстве случаев при неонатальных пневмониях наблюдается двустороннее поражение интерстициальной ткани и альвеол, которое вызывает тяжелые гипоксические расстройства и связанный с ними ацидоз. Сочетание гипоксемии и нарушений кислотно-основного равновесия провоцирует полиорганную недостаточность. В первую очередь страдает сердечно-сосудистая система, а при тяжелом течении и другие органы — почки, печень, головной мозг.
Независимо от причины, пневмонии у новорожденных протекают в 3 стадии. Сначала происходит инфильтрация (первая неделя болезни), когда поражаются преимущественно периферические отделы легких. На второй неделе начинается стадия рассасывания, характеризующаяся уменьшением процента затемненных участков и повышением пневматизации. На третьей неделе наступает этап интерстициальных изменений и деформации легочного рисунка.
Классификация
В зависимости от причины, у новорожденных выделяют бактериальную, вирусную, грибковую или протозойную формы заболевания. Если патология возникла при отсутствии других очагов инфекции в организме, ее называют первичной. Вторичное воспаление легких формируется при аспирационном синдроме, сепсисе. В современной неонатологии важна классификация пневмоний по времени развития на 2 группы:
- Врожденные. Инфицирование в этом случае происходит анте- или интранатально, а первые клинические признаки определяются в течение 3 суток после родов. Частые причины врожденного воспаления — внутриутробные инфекции.
- Приобретенные (постнатальные). Заражение патогенными микробами происходит в роддоме (нозокомиальная форма) или после выписки младенца (внебольничная форма). Симптомы выявляются спустя 72 часа после рождения ребенка, но не позже 28 дня жизни.
Симптомы пневмонии у новорожденных
У новорожденных пневмонии преимущественно проявляются неспецифическими дыхательными расстройствами. Наблюдается частое и шумное дыхание, сопровождающееся «хрюкающими звуками». При этом крылья носа раздуваются, межреберные и надключичные промежутки втягиваются. Кожа вокруг рта и на кончиках пальцев синеет, при нарастании дыхательной недостаточности отмечается тотальный цианоз.
Кашель у новорожденного обычно отсутствует. Изо рта периодически выделяется слизь или пена с неприятным запахом. Симптоматика дополняется общими признаками: отказом от сосания груди, повышением температуры тела, патологической возбудимостью или угнетением ЦНС. В неонатальном периоде пневмониям сопутствует инфекционный токсикоз, для которого характерен серый оттенок кожи, геморрагическая сыпь, желтуха и гепатоспленомегалия.
Осложнения
Болезнь может приводить к отеку легких, гнойно-деструктивным процессам (абсцессам, буллам, гангрене), пиопневмотораксу. Продолжительные дыхательные расстройства у новорожденных провоцируют гипоксическую энцефалопатию, кардиопатию, нефропатию. Наиболее тяжело протекают пневмонии у недоношенных детей: они часто заканчиваются генерализацией инфекции и сепсисом, а в 40% вызывают летальный исход.
Диагностика
Неонатолог начинает обследование со сбора анамнеза матери (течение беременности и родов, экстрагенитальные патологии), чтобы предположить причины дыхательных нарушений у новорожденного. Физикальные данные малоинформативны, поскольку у младенцев намного труднее выявить хрипы и крепитацию при аускультации. Расстройства дыхания оценивают по шкале Сильвермана или Даунса. Основными диагностическими методами для верификации возможной пневмонии у новорожденных являются:
- Рентгенография ОГК. Основной метод, который показывает очаговые или тотальные затемнения в легких, состояние плевральных синусов, наличие признаков РДС по типу «матового стекла». На снимках врач может обнаружить врожденные пороки дыхательной системы, ставшие предрасполагающим фактором заболевания.
- Микробиологическое исследование. Для установления инфекционной причины пневмонии проводят бакпосев отделяемого из зева, мокроты или трахеобронхиального аспирата. Полученные микроорганизмы исследуют на чувствительность к антибиотикам. При подозрении на сепсис выполняется посев крови на стерильность.
- Серологические реакции. Определение антител к врожденным инфекциям (цитомегаловирус, краснуха) необходимо для выяснения характера пневмонии, если типичные возбудители исключены. При визуализации на рентгенографии признаков так называемой «белой» пневмонии назначают серологические тесты на сифилис (РСК, РИБТ).
- Анализы крови. Клиническое и биохимическое исследования рекомендованы для выявления маркеров воспалительной реакции, которые соотносятся с тяжестью и прогнозом болезни. Неблагоприятным считается высокий лейкоцитарный индекс интоксикации и возрастание уровня СРБ более 10 мг/л.
Лечение пневмонии у новорожденных
Консервативная терапия
Лечение младенцев с воспалением легких проводится только стационарно: в отделении патологии новорожденных или в блоке реанимации и интенсивной терапии. Основу лечения составляют антибиотики, которые сначала подбираются эмпирически, а затем корректируются после получения результатов бактериологической диагностики. В неонатологии в основном используют бета-лактамные препараты и макролиды. Как патогенетические методы применяются:
- Кислородная поддержка. Обеспечение нормальной сатурации — первостепенная задача врачей, поскольку это снижает риск метаболических и полиорганных нарушений. Рекомендована неинвазивная вентиляция (бифазик, CIPAP), в тяжелых случаях ребенка переводят на ИВЛ.
- Иммунотерапия. Для стимуляции собственных защитных сил организма новорожденного назначают иммуноглобулины II поколения, которые включают комплекс IgG, IgM, IgA (пентаглобин).
- Инфузионная терапия. Для восполнения ОЦК и коррекции электролитных показателей показано внутривенное вливание растворов. Базовым считается 10% раствор глюкозы, который обеспечивает организм энергией. При гипоксических нарушениях эффективно ведение неотона.
Прогноз и профилактика
Вероятность полного выздоровления высокая у доношенных новорожденных без врожденных пороков и иммунодефицитов. Менее благоприятнен прогноз у недоношенных младенцев, особенно когда они требуют кислородной поддержки на ИВЛ. Профилактика неонатальных пневмоний включает антенатальную охрану плода, своевременную диагностику и лечение инфекций у беременной, предотвращение РДС путем введения дексаметазона при высоком риске преждевременных родов.
Источник
Комментарии
Опубликовано в журнале:
Детский доктор »» № 6, 2000
КОНСПЕКТ ВРАЧА
Л.С. Страчунский, Л.П. Жаркова
Пневмония – одно из наиболее серьезных заболеваний у детей, особенно первых лет жизни. Как и у взрослых, в настоящее время пневмонию у детей разделяют на развившуюся во внебольничных условиях (внебольничная пневмония) и развившуюся в стационаре (нозокомиальная, госпитальная пневмония). Внебольничная пневмония (ВП) в зависимости от степени тяжести, возраста ребенка, фоновых заболеваний может лечиться как на дому, так и в стационаре. Особую категорию составляют случаи ВП, требующие терапии в отделениях реанимации и интенсивной терапии. В настоящей публикации рассматривается ВП, развившаяся у ранее здоровых детей.
Этиология и выбор антибактериальных препаратов
Во многих возрастных группах лидирующей причиной ВП являются вирусы, однако, несмотря на это, всем детям с пневмонией назначают антибиотики, так как доступные практикующему врачу методы исследования не позволяют достаточно быстро и точно дифференцировать этиологию заболевания. К тому же во многих случаях вирусная пневмония переходит в вирусно-бактериальную.
Основу терапии ВП составляют β-лактамы (амоксициллин, амоксициллин/клавуланат, цефалоспорины II – Ш поколений) и макролиды. Неэффективность начальной терапии β-лактамами может говорить как о резистентности микрофлоры, так и об «атипичной» этиологии ВП (Mycoplasma pneumoniae, Clamydophila pneumoniae). Дозы антибиотиков приведены в таблице.
| Возраст | Наиболее частые возбудители | Препарат выбора | Альтернативный препарат |
| Новорожденные | Стрептококк группы В, Enterobacteriaceae (E.coli и др.) | АМП+АГ (в т.ч. при листериозе), АМО/КК или АМП/СУЛ±АГ | Цефотаксим±АГ±АМП |
| 1 – 3 мес. | Вирусы, Enterobacteriaceae (E.coli и др.), H.influenzae, C.trachomatis, S.aureus | АМО/КК, АМП/СУЛ, АМП+Макролид | ЦС II – III |
| 3 мес. – 5 лет | Вирусы, S.pneumoniae, H.influenzae | Внутрь: АМО, АМО/КК, Макролид | Внутрь: ЦС-П, Эритромицин Парентерально: АМП, ЦС II-III |
| >5 лет | S.pneumoniae M.pneumonie, C.pneumoni | Внутрь: АМО, Макролид | Внутрь: АМО/КК, ЦС-II Парентерально: Пеницилин, ЦС II – III, Линкосамид |
| Осложнения ВП (плеврит, деструкция) | S.pneumaniae, H.influenzae, Enterobacteriaceae, S.aureus | Парентерально: АМО/КК, АМП/СУЛ | Парентерально: ЦС II – IV, Цефазолин+АГ, Линкосамид+АГ, Карбапенем |
АГ – аминогликозиды, АМП – ампициллин, АМО – амоксициллин, КК – клавулановая кислота, СУЛ – сульбактам, ЦС II – IV – цефалоспорины II – IV поколений: II – цефуроксим, III – цефотаксим, цефтриаксон, цефоперазон, IV — цефепим
Чувствительность возбудителей к антибиотикам
S.pneumoniae: в России большинство штаммов чувствительны к пенициллину, что позволяет использовать при лечении ВП амоксициллин и цефалоспорины. К ко-тримоксазолу более 1/3 штаммов пневмококка устойчивы. Пневмококки полностью устойчивы к гентамицину и другим аминогликозидам, поэтому терапия ВП антибиотиками данной группы в амбулаторных условиях недопустима.
S.pyogenes: стрептококк группы В (S.agalactiae) всегда чувствительны к пенициллинам и цефалоспоринам.
H.influenzae: большинство штаммов чувствительны к аминопенициллинам (АМО, АМП), азитромицину, ЦС II – IV. Резистентность к амино-пенициллинам обусловлена продукцией β-лактамаз, но при этом сохраняется высокая чувствительность к АМО/КК и ЦС II – IV.
Стафилококки: сохраняется чувствительность внебольничных штаммов к оксациллину, ингибиторозащищенным пенициллинам, линкоса-мидам, цефалоспоринам.
Грамотрицательные бактерии из семейства Enterobacteriaceae (E.coli и др.) чаще всего резистентны к аминопенициллинам, при подозрении на эти возбудители следует отдавать предпочтение ингибиторозащищенным аминопенициллинам (АМО/КК, АМП/СУЛ) или ЦС-III.
Атипичные возбудители – хламидии (C.trachomatis, C.pneumoniae) и микоплазмы (M.pneumoniae) – всегда чувствительны к макролидам и тетрациклинам.
Путь введения антибиотиков
Неосложненные пневмонии, особенно в амбулаторных условиях: предпочтительно введение внутрь. При парентеральном введении препа-ратов по достижении эффекта следует перейти на пероральное введение антибиотика (ступенчатая терапия).
Длительность терапии
При адекватном выборе антибиотика и быстром наступлении эффекта бывает достаточно 7 – 10 дней.
При ВП, вызванных атипичными возбудителями, макролиды применяют в течение 14 дней.
Типичные ошибки при лечении внебольничной пневмонии
Типичные ошибки | Комментарии |
| Выбор препарата | |
| Гентамицин | Аминогликозиды неактивны в отношении пневмококка |
| Ампициллин внутрь | Низкая биодоступность при приеме внутрь |
| Ко-тримоксазол | Высокая резистентность S.pneumoniae и H.influenzae, частые кожные аллергические реакции, наличие более безопасных препаратов |
| Фторхинолоны | Детям противопоказаны |
| Сочетание антибиотиков с нистатином И/или антигистаминными препаратами | Отсутствие доказательств профилактической эффективности, необоснованные затраты |
Длительность терапии | |
Частая смена антибиотиков в лечении, из-за «опасности» развития резистентности | Показания для замены антибиотиков: |
Антибиотикотерапия до полного исчезновения рентгенологических и/или лабораторных изменений | Основным критерием отмены антибиотиков является регресс клинических симптомов. Сохранение отдельных лабораторных и/или рентгенологических изменений не является основанием к продолжению антибиотикотерапии |
Л.С. Страчунский, Л.П. Жаркова. Антибиотикотерапия внебольничной пневмонии
Таблица.
Дозы антибиотиков для лечения внебольничной пневмонии у детей
Препарат | Суточная доза при приеме внутрь | Кратность приема | Суточная доза при парентеральном введении | Кратность, путь введения | ||
| 1 мес. – 12 лет | >12лет | 1 мес. – 12 лет | >12 лет | |||
ПЕНИЦИЛЛИНЫ | ||||||
| Бензилпенициллин | – | 50 – 100 тыс. ЕД/кг/сут | 4 – 12 млн. ЕД/сут | в 4 введения в/в, в/м | ||
| Ампициллин | 30 – 50 мг/кг/сут* | 2 – 4 г/сут* | в 4 приема за 1 ч до еды | 50 – 100 мг/кг/сут | 2 – 8 г/сут | в 4 введения в/в, в/м |
| Амоксициллин | 30 – 60 мг/кг/сут | 1,5 г/сут | в 3 приема | |||
| Оксациллин | 40 – 60 мг/кг/сут** (не более 1,5 г/ сут) | 2 г/сут** | в 3 – 4 приема | 200 – 300 мг/кг/сут | 4 – 12 г/сут | в 4 – 6 введений в/в, в/м |
ИНГИБИТОРОЗАЩИЩЕННЫЕ ПЕНИЦИЛЛИНЫ | ||||||
| Амоксициллин/ клавуланат | 20 – 40 мг/кг/сут (по амоксициллину) | 1,5 г/сут (по амоксициллину) | в 3 приема, во время еды | разовая доза 30 мг/кг | 3,6-4,8 г/сут | только в/в, до 3 мес. в 3 введения, более старшим в 3 – 4 введения |
| Ампициллин/ сульбактам | 50 мг/кг/сут | 1,5 г/сут | в 2 приема | 150 мг/кг/сут | 6 -12 г/сут | в 3 – 4 введения в/в, в/м |
| ЦЕФАЛОСПОРИНЫ | ||||||
| Цефазолин | – | 50 – 100 мг/кг/сут | 3 – 6 г/сут | В 2 – 3 введения в/в, в/м | ||
| Цефуроксим | 30 – 40 мг/кг/сут | 0,5 – 1,0 г/сут | в 2 приема, во время еды | 50 – 100 мг/кг/сут | 2,25 – 4,5 г/сут | в 3 введения в/в, в/м |
| Цефотаксим | – | 50 – 100 мг/кг/сут | 3 – 6 г/сут | в 2 – 3 введения в/в, в/м | ||
| Цефоперазон | – | 50 – 100 мг/кг/сут | 4 – 6 г/сут | в 2 введения в/в, в/м | ||
| Цефтриаксон | – | 50 – 75 мг/кг/сут | 1 – 2 г/сут | в 1 введение в/в, в/м | ||
| Цефепим | – | 50 – 100 мг/кг/сут | 2 – 4 г/сут | в 2 введения в/в, в/м | ||
КАРБАПЕНЕМЫ | ||||||
| Имипенем | – | 60 – 100 мг/кг/сут | 2 г/сут | в 3 – 4 введения в/в | ||
| Меропенем | – | 60 мг/кг/сут | 2 г/сут | в 3 – 4 введения в/в, в/м | ||
АМИНОГЛИКОЗИДЫ | ||||||
| Гентамицин | – | 6 мг/кг/сут | 6 мг/кг/сут | в 1 введение в/в, в/м | ||
| Нетилмицин | – | 6 мг/кг/сут | 6 мг/кг/сут | в 1 введение в/в, в/м | ||
| Амикацин | – | 15 – 20 мг/кг/сут | 15 – 20 мг/кг/сут | в 1 введение в/в, в/м | ||
МАКРОЛИДЫ | ||||||
| Эритромицин | 40 – 50 мг/кг/сут | 1 – 2 г/сут | в 3 – 4 приема натощак | 40 – 50 мг/кг/сут | 2 – 4 г/сут | в 3 – 4 введения в/в |
| Мидекамицин | 30 – 50 мг/кг/сут | 1,2 г/сут | в 3 приема | – | ||
| Спирамицин | 150 000 ЕД/кг/сут | 1,5 – 3,0 млн ЕД/сут | в 2 – 3 приема | – | 4,5 – 9 млн ЕД/сут | в 2 введения в/в |
| Рокситромицин | 8 мг/кг/сут | 0,3 г/сут | в 2 приема | – | ||
| Азитромицин | 3-дневный курс: 10 мг/кг/сут или 5-дневный курс: 10 мг/кг в 1-й день, затем по 5 мг/кг | 0,5 г/сут, 0,5 г/сут в 1-й день, затем по 0,25 г/сут | в 1 прием | – | ||
| Кларитромицин | 15 мг/кг/сут | 0,5 – 1,0 г/сут | в 2 приема | – | 1,0 г/сут | в 2 введения в/в |
ЛИНКОСАМИДЫ** | ||||||
| Линкомицин | 30 – 60 мг/кг/сут | 1,0 – 2,0 г/сут | в 3 – 4 приема | 10 – 20 мг/кг/сут | 1,2 г/сут | в 2 – 3 введения в/в, в/м |
| Клиндамицин | 10 – 25 мг/кг/сут | 0,6 – 1,8 г/сут | в 3 – 4 приема | 10 – 40 мг/кг/сут | 1,8 – 2,4 г/сут | в 3 – 4 введения в/в, в/м |
ТЕТРАЦИКЛИНЫ | ||||||
| Доксициклин | – | 0,2 г/сут | в 1 – 2 приема | – | 0,2 г/сут | в 1 – 2 введения в/в |
* – внутрь можно применять только при отсутствии амоксициллина.
** – низкая биодоступность, внутрь лучше не применять.
Литература
1. Антибактериальная терапия. – Практическое руководство./ Под редакцией Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. – М., 2000.
2. Антибактериальная терапия пневмонии у детей. – Пособие для врачей. // Клиническая микробиология и антимикробная химиотерапия. – 2000. Т.2(1).- с. 77 – 87.
3. Medicines for children. Royal College of Paediatrics and Child Health. London, 1999.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
Инфекционно-воспалительные заболевания – наиболее частая патология у детей периода новорожденности, что объясняется своеобразием защитных механизмов на данном этапе онтогенеза. Наиболее выражена недостаточность гуморального и клеточного иммунитета, незрелость барьерных функций кожи и слизистых у детей, родившихся преждевременно. В структуре диагнозов в отделениях второго этапа выхаживания недоношеных детей удельный вес гнойно-воспалительных заболеваний приближается к 80%, при этом большинство заболеваний составляют так называемые малые инфекции – гнойничковые сыпи, омфалит, дакриоцистит, отит; у 1% детей выявляются серьезные воспалительные заболевания (флегмона и пузырчатка новорожденных, остеомиелит, менингоэнцефалит, пневмония, сепсис).
В последние годы проблемы инфекционной патологии у незрелых детей приобрели особую актуальность в связи с изменением особенностей как макро-, так и микроорганизмов, что отразилось на течении инфекционного процесса. Утяжелилось течение фоновых состояний, создающих благоприятную почву для манифестации и прогрессирования инфекции – это перинатальные поражения мозга, врожденные пороки развития, пневмопатии; причем достижения современной реаниматологии и интенсивной терапии позволяют обеспечить выживание даже детей с крайне малой массой тела, перенесших тяжелую асфиксию. В свою очередь реанимационные мероприятия, прежде всего длительная ИВЛ и катетеризация магистральных сосудов, создают условия для микробной агрессии. Одним из важных факторов, способствующих бактериальной контаминации и утяжелению течения бактериальных инфекций, является наличие смешанной вирусно-бактериальной внутриутробной инфекции. Внутриутробные паразитарные и вирусные инфекции (так называемый TORCH-синдром) в 13–45% случаев являются основной причиной смертности в периоде новорожденности. Перенесенная внутриутробно специфическая инфекция резко нарушает защитные механизмы ребенка, что способствует присоединению и бурному течению интранатальных и постнатальных бактериальных инфекций.
Современная этиология возбудителей
В этиологической структуре возбудителей бактериальных инфекций у недоношенных детей 10–15 лет назад отмечалось увеличение удельного веса грамотрицательной флоры (клебсиела, протей, псевдомонас). Однако в последующие годы вновь среди этиологических агентов локальных гнойно-воспалительных поражений первое место занимает грамположительная флора (стафилококки, стрептококки). Для недоношенных детей характерны сочетание микроорганизмов, выделяемых из различных очагов (например, из гнойного очага высеваются золотистый и эпидермальный стафилококки, из кала – кишечная палочка и стафилококки), а также смена ведущих возбудителей в процессе лечения (первоначальные агенты воспаления подавляются, их место занимают другие бактерии, часто в сочетании с грибами).
Среди населения циркулируют преимущественно чувствительные к антибиотикам штаммы возбудителей (В.К.Таточенко), а в стационарах дети обсеменяются преимущественно устойчивыми штаммами (внутрибольничная флора), так как условно-патогенные и сапрофитные микроорганизмы многократно пассируются на ослабленных незрелых новорожденных и происходит их селекция под воздействием терапии (Г.В.Яцык, И.В.Маркова). Кроме того, устойчивые штаммы (клебсиеллы, стрептококк В) передаются новорожденным от больных матерей.
Специфика фармакокинетики антибиотиков
У новорожденных детей фармакокинетика любого препарата существенно отличается от таковой у детей более старшего возраста; в наибольшей мере это относится к незрелым (недоношенным) новорожденным. Крайне важной представляется незрелость выделительной функции почек и ферментных систем печени – эти особенности в первую очередь характерны для глубоконедоношенных детей с массой тела менее 1500 г. Помимо этого, незрелость других органов и систем (желудочно-кишечного тракта, нервной системы, органов дыхания), а также общая лабильность метаболизма накладывают на фармакокинетику антибиотиков у недоношенных детей индивидуальные особенности предопределяя высокий риск нежелательных побочных эффектов антибактериальной терапии. Общая особенность фармакокинетики любых препаратов у недоношенных детей – это ее замедление, что способствует кумуляции лекарств и влияет на выбор дозы (уменьшение ее на 1/3–1/4), путей и кратности введения препаратов. В то же время повышенная проницаемость естественных барьеров (кожи и слизистых) способствует всасыванию многих медикаментов. В настоящее время проводятся исследования суточных ритмов фармакодинамики различных препаратов, но в отношении антибиотиков у недоношенных детей таких исследований практически нет.
Показания и выбор антибиотика
Безусловным показанием для назначения антибиотикотерапии недоношенному новорожденному является наличие у него любого инфекционно-воспалительного процесса, включая так называемые малые инфекции, например, нераспространенные гнойничковые поражения кожи, гнойные конъюнктивиты, отиты (в том числе катаральный отит). Лишь в редких случаях легкого течения неосложненной ОРВИ (ринофарингит) антибиотик не назначается – и то только у детей с относительно благополучным фоном (незначительная степень недоношенности, отстутствие анамнестических указаний на внутриутробную инфекцию, нетяжелая перинатальная энцефалопатия).
Безусловным показанием для назначения антибиотикотерапии недоношенному новорожденному является наличие у него любого инфекционно-воспалительного процесса, включая так называемые малые инфекции, например, нераспространенные гнойничковые поражения кожи, гнойные конъюнктивиты, отиты (в том числе катаральный отит). Лишь в редких случаях легкого течения неосложненной ОРВИ (ринофарингит) антибиотик не назначается – и то только у детей с относительно благополучным фоном (незначительная степень недоношенности, отстутствие анамнестических указаний на внутриутробную инфекцию, нетяжелая перинатальная энцефалопатия).
Спорный вопрос о так называемом профилактическом применении антибиотиков у маловесных недоношенных из группы риска по реализации внутриутробной и интранатальной инфекции (больная мать, длительный безводный период и т.п.), как правило, решается в пользу назначения антибиотика, так же как и в случаях так называемых неинфекционных пневмопатий. К условно “профилактическим” можно отнести также назначение антибиотика для “прикрытия” гормональной кортикостероидной терапии и некоторых вмешательств (катетеризации, переливания крови и т.п.).
Выбор антибиотика для недоношенного ребенка – ответственный момент, во многом определяющий эффективность лечения. При выборе препарата следует учитывать следующие факторы:
• вид возбудителя (в начале лечения часто лишь предполагаемый) и его штамм;
• чувствительность возбудителя (также в начале лечения – предполагаемую, через 2–3 дня после получения результатов бактериологических анализов в терапию могут быть внесены коррективы). В последние годы высказывается мнение о том, что параметры чувствительности микробов in vitro не всегда совпадают с таковыми in vivo и нет необходимости строго следовать им при назначении препаратов;
• локализация и степень тяжести инфекционного процесса (при нетяжелых локальных поражениях возможно пероральное применение препарата; при тяжелых, как правило, – сочетание пероральных и парентеральных средств);
• сопутствующие состояния и премобидный фон (предпочтение парентеральных препаратов при тяжелом дисбактериозе или внутривенного введения у крайне маловесных детей с неразвитой мышечной тканью).
Все антибиотики можно условно разделить на 2 группы – препараты первого выбора назначают, когда нет оснований думать о лекарственной устойчивости флоры (полусинтетические пенициллины, аминогликозиды I поколения, цефалоспорины I поколения); препараты второго выбора направлены на преодоление устойчивых штаммов (аминогликозиды и цефалоспорины III–IV поколения, современные макролиды). Существуют и препараты третьего выбора (или препараты резерва), применяемые при крайне тяжелых формах заболеваний с полирезистентной флорой (карбапенемы).
У недоношенных детей в основном сразу используются препараты второго выбора: применение антибиотиков первого ряда у них неэффективно и лишь способствует отсрочке манифестных проявлений инфекционного процесса, маскирует клинические симптомы. У детей периода новорожденности даже по жизненным показаниям не должны использоваться препараты, обладающие высокой токсичностью (фторхинолоны).
Схема 1. Допустимые сочетания антибиотиков у недоношенных детей при одновременном применении (Г.В. Яцык)
Особенности дозировки антибиотиков
Дозировки используемых в неонатологии антибиотиков для недоношенных детей и кратность их введения представлены в табл. 1 (Г.В. Яцык, 1998 г.) Общий принцип подбора дозы для новорожденного ребенка – большее по сравнению со старшими детьми количество препарата на 1 кг массы тела – сохраняется и у недоношенных детей. Это обусловлено большим процентным содержанием воды в организме новорожденного и большей относительной поверхностью тела.
Дозировки используемых в неонатологии антибиотиков для недоношенных детей и кратность их введения представлены в табл. 1 (Г.В. Яцык, 1998 г.) Общий принцип подбора дозы для новорожденного ребенка – – сохраняется и у недоношенных детей. Это обусловлено большим процентным содержанием воды в организме новорожденного и большей относительной поверхностью тела.
Комбинированная терапия
Комбинированная антибактериальная терапия у недоношенных детей должна проводиться с большой осторожностью; одновременное сочетание 2 (очень редко – 3) антибиотиков применяется лишь у детей с тяжелыми гнойно-воспалительными процессами (прежде всего при сепсисе), вызванными смешанной флорой. Допустимые сочетания антибиотиков представлены в табл. 2 и на схеме 1 (данные Н.В. Белобородовой).
Пути и кратность введения антибиотиков недоношенному ребенку
В связи с высокой проницаемостью и ранимостью слизистой желудочно-кишечного тракта у незрелых новорожденных, а также опасностью развития дисбиоза и язвенно-некротического энтероколита пероральные антибиотики использовались ограниченно. К тому же большинство инфекционных заболеваний у недоношенных детей по тяжести состояния требует более мощной терапии. В последние годы появились достаточно действенные антибактериальные и противогрибковые препараты для перорального применения (макролиды, амоксициллин/клавуланат и др.) Кроме того, установлено крайне негативное воздействие болевых раздражений на грудных детей, что делает необходимым ограничение внутримышечных и внутривенных инъекций.
У новорожденных (особенно недоношенных) детей период полувыведения препаратов увеличен вследствие незрелости почек и печени. Поэтому кратность введения большинства препаратов не превышает у них 2 раз в течение суток (за исключением пенициллинов); особенно популярными в неонатологии остаются препараты пролонгированного действия (рокситромицин, цефтриаксон), допускающие однократное применение. Некоторые исследователи (Н.В. Белобородова, О.Б. Ладодо) большинство парентеральных препаратов (в том числе аминогликозиды, цефалоспорины) предлагают вводить однократно – внутривенно или внутримышечно.
Продолжительность терапии
Продолжительность антибактериальной терапии и последовательность применяемых антибиотиков у недоношенного ребенка определяются индивидуально, они зависят от эффективности первичного курса антибактериальной терапии, которая оценивается по традиционным клиническим и лабораторным параметрам. Как правило, недоношенным детям со среднетяжелыми инфекционными процессами (омфалит, пневмония, отит и т.д.) проводят два последовательных курса антибиотика (второй курс с учетом чувствительности микрофлоры), каждый по 7–10 дней. При тяжелых заболеваниях (менингит, остеомиелит, сепсис) обычно используют не менее 3–4 курсов антибиотиков (или 2–3 курса; при первом – сочетание антибиотиков, обычно аминогликозида и цефалоспорина III–IV поколения).
Побочные явления и их профилактика
Наиболее распространенные у недоношенных новорожденных нежелательные побочные эффекты антибактериальной терапии обусловлены подавлением симбионтной микрофлоры и, как следствие, колонизацией организма условно-патогенными сапрофитами. В связи с этим даже после короткого курса антибактериальной терапии у недоношенных детей возможно развитие дисбиозов – кандидоза кожи и слизистых, кишечного дисбактериоза. Реже у недоношенных отмечаются токсические (по типу идиосинкразии) и аллергические реакции на антибиотики.
Профилактика осложнений антибактериальной терапии начинается уже с ее правильного подбора, тщательного индивидуального контроля. Одновременно с назначением антибиотиков ребенку необходимо назначать противогрибковые средства (леворин, флуконазол, амфотерицин В) и средства, восстанавливающие микрофлору кишечника (бифидум-бактерин и др.); причем использование последних продолжается не менее недели после окончания курса антибиотиков.
С целью снижения нагрузки антибиотиками на незрелый организм недоношенного ребенка в последние годы делаются попытки сочетания антибактериальной терапии со средствами, усиливающими неспецифическую защиту: иммуноглобулинами, лазеротерапией (использование низкоинтенсивного лазерного излучения на магистральные сосуды с целью иммуностимуляции), метаболитной коррекцией.
Источник
