Ожоги и рубцовые сужения пищевода реферат
Реферат
На тему: «Рентгенодиагностика невоспалительных заболеваний пищевода. Ожоги и рубцовый стеноз пищевода. Варикозное расширение вен пищевода. Рентгенодиагностика доброкачественных опухолей пищевода»
Выполнил: Бредихина А.А.
Проверил: Евдокимов С.Н.
Дата: 24 февраля 2005 г.
Барнаул 2005 г.
Ожоги и рубцовый стеноз пищевода
Различают химические, термические и лучевые ожоги пищевода, чаще встречаются химические и термические; химические ожоги обычно являются следствием воздействия едких щелочей и кислот.
Степень повреждения пищевода зависит от концентрации и количества принятого вещества, возникающего спазма пищевода, неврологического статуса больного, индивидуальной чувствительности организма и сроков оказания специализированной помощи. Щелочи, воздействуя на слизистую оболочку пищевода, вызывают колликвациюю белков, в результате чего действие их более глубокое. Кислоты вызывают коагуляционный некроз. При ожогах кислотами чаще, чем щелочами, поражается желудок с образованием в последующем рубцового стеноза привратника. Ожоги пищевода и нередко возникающие впоследствии рубцовые сужения возникают, как правило, в местах физиологических сужений. Объясняется это тем, что в этих областях вследствие относительно более длительной задержки, застаивания и, следовательно, более длительного воздействия принятой жидкости на стенку пищевода образуются более сильные ожоги, чем в других участках пищевода. Может быть, этому способствует также возникновение спазма в местах физиологических сужений, обусловленного воздействием сильно раздражающего агента, который здесь дольше задерживается. По-видимому, этим объясняется также и то обстоятельство, что особенно часто рубцовые сужения пищевода, наступающие после ожога, располагаются над кардией (спазм кардии во время действия раздражающего агента).
Ядовитое вещество оказывает обжигающее действие на стенку пищевода и общее воздействие на организм. Условно различают четыре стадии патологических изменений при ожоге:
1. гиперемия и отек слизистой оболочки;
2. некроз и изъязвление;
3. грануляция;
4. рубцевание.
Заживление при ожогах происходит медленно, развивающаяся соединительная ткань в течение 2—6 мес рубцуется и сморщивается. При повреждениях только слизистой оболочки образуется поверхностный рубец без сужения просвета пищевода. При поражении более глубоких слоев стенки пищевода развивается склерозированная рубцовая ткань. Этот процесс авторы называют хроническим коррозивным эзофагитом. В процесс нередко вовлекается и околопищеводная клетчатка, образуются сращения и деформация пищевода.
Клиническая диагностика ожогов пищевода в остром периоде не представляет трудностей. Она базируется на обнаружении характерных для того или иного агента пятен на слизистой губ и полости рта. От серной и соляной кислоты пятна серовато-белого цвета, от азотной — желтого или желтовато-бурого, от хромовой — буро-красного и т. д.
В клинической картине выделяют четыре стадии (Петров, Ванцеян):
1. в I стадии наблюдаются резкий отек слизистой оболочки и подслизистого слоя, гиперемия и некроз тканей;
2. во II стадии происходит отторжение некротических масс, вследствие чего увеличивается интоксикация, образуются язвы;
3. в III стадии интоксикация уменьшается, самочувствие больных улучшается, происходит развитие грануляционной ткани;
4. в IV стадии появляются жалобы на затрудненное прохождение пищи вследствие развивающихся стриктур.
Три основных фазы по Тагеру:
1. период острых явлений в первые часы и сутки;
2. период демаркации в первые 7 —10 дней;
3. период рубцевания.
Три периода по Ильченко:
1. острых явлений;
2. мнимого благополучия;
3. рубцевания.
На основании рентгенологической картины в первом периоде выделяют еще три степени:
I — легкий ожог;
II — ожог средней тяжести ;
III — тяжелый ожог.
Несмотря на то что выделение степеней, условно, тем не менее уточнение состояния пищевода во многом определяет прогноз заболевания и позволяет провести адекватное лечение.
Рентгенологическое исследование целесообразно проводить всем больным в ранние сроки, кроме находящихся в состоянии шока, для установления характера изменений в пищеводе. Исследование начинают с обзорной рентгеноскопии, а по мере надобности выполняют рентгенографию органов грудной и брюшной полости. Для исследования пищевода в зависимости от состояния больного, периода ожогового процесса и целей исследования используют жидкую бариевую взвесь, масляные и водорастворимые контрастные вещества.
При I степени отравления состояние больных удовлетворительное, боли при глотании выражены нерезко. Жидкая бариевая взвесь свободно проходит по пищеводу, просвет его обычный, в нем содержится небольшое количество слизи, складки слизистой оболочки не изменены, местами сглажены или утолщены, перистальтика прослеживается. У некоторых больных отмечается регургитация.
При II степени отмечаются сильные боли, особенно при глотании. Просвет пищевода чаще расширен, но может быть и сужен за счет отека и спазма, в просвете значительное количество слизи. Складки слизистой оболочки выявляются неотчетливо из-за слизи. Перистальтика ослаблена или совсем не определяется. Эластичность стенок снижена. Выражена регургитация. По ходу пищевода возникает спазм.
При ожоге III степени глотание затруднено, выражен болевой синдром. Наблюдается резко выраженная картина эзофагита (рис. 1); пищевод расширен с первого дня отравления, в просвете много слизи, складки слизистой оболочки не определяются, отторгнутые участки слизистой оболочки создают картину дефектов наполнения, выражена атония пищевода, бариевая взвесь тонет в содержимом.
Рис. 1. Рентгенограмма пищевода в левой косой проекции. В просвете умеренно расширенного пищевода много слизи, складки слизистой оболочки не видны.
Через 8—12 дней воспалительные явления стихают. Рубцовые изменения начинают развиваться спустя 2 нед и более; рубцовый процесс обычно стабилизируется через 6 мес, а иногда и позже.
В зависимости от степени выраженности послеожоговые стриктуры делят на две группы:
1. к первой он относит сужения с просветом более 6—7 мм, которые не являются препятствием для прохождения хорошо прожеванной пищи. Такие стриктуры обычно покрыты бледной слизистой оболочкой без признаков эзофагита;
2. вторая группа — стриктуры менее 6 мм, при которых нарушается продвижение пищевых масс, и отмечаются характерные явления эзофагита. Слизистая оболочка в месте сужения гиперемирована, нередко наблюдаются эрозии, иногда разрастания грануляционной ткани.
Ранним рентгенологическим симптомом рубцовых изменений является ригидность стенок. Для послеожоговых стриктур характерны их большая протяженность и множественность. Контуры суженных отделов чаще ровные, но могут быть и неровными. Складки слизистой оболочки ввиду резкого сужения чаще не определяются, в других же случаях прослеживаются только на отдельных участках. При нерезко выраженном сужении они широкие, продольные, местами сглажены. В процессе исследования в области сужения почти постоянно определяется спазм, увеличивающий степень сужения.
Перистальтика в измененных отделах пищевода не определяется. Постоянное нарушение проходимости в суженных отделах ведет к развитию супрастенотического расширения, выраженность которого зависит от уровня, степени и длительности существования сужения, характера питания больного. Расширение тем больше, чем ниже расположена, выраженное и длительное существует стриктура. Если больные с момента появления дисфагии сразу переходят на питание жидкой пищей, то супрастенотическое расширение менее выражено. Переход расширенного участка в суженный обычно имеет форму воронки, в ряде случаев наблюдается нависание стенки расширенного отдела над суженным. При небольшом сужении просвета пищевода супрастенотическое расширение может отсутствовать (рис. 2), но ригидность стенок отчетливо выражена. Описанная выше рентгенологическая картина патогномонична для рубцовых сужений. Однако в некоторых случаях ни один из указанных симптомов не выявляется (рис. 3), и тогда решающее значение в диагностике имеет анамнез. В случаях почти полной или полной непроходимости для определения протяженности и нижней границы сужения применяют ретроградное контрастирование через гастростому.
Рис.2. Рентгенограммы пищевода, равномерно суженного на всем протяжении, с ригидными стенками. Супрастенотическое расширение отсутствует.
Рис. 3. Рентгенограмма пищевода в левой косой проекции. Циркулярное сужение IV пищеводного сегмента (ТVII) с ровными контурами. Выше просвет пищевода расширен и нависает над сужением.
В качестве важного диагностического признака можно отметить наличие явлений регургитации контрастной взвеси: вначале контрастная взвесь располагается над местом стеноза, образуя в верхней части горизонтальный уровень; в дальнейшем под влиянием глотания и перистальтики пищевода происходит постепенное уменьшение высоты столба контрастной взвеси и одновременное увеличение его ширины. После этого контрастная взвесь внезапно выбрасывается кверху, заполняя весь пищевод; ширина пищевода при этом значительно уменьшается на всем протяжении. Последнее явление объясняется тем, что под влиянием сильной перистальтики контрастная взвесь, не имея возможности пройти через суженное место вниз, по направлению к желудку, находит обратный путь кверху, заполняя весь пищевод.
При ожогах, пищевода в различные сроки после отравления могут развиваться осложнения со стороны пищевода, легких, средостения. При тяжелых ожогах вследствие глубоких некрозов нередко образуются пищеводно-бронхиальные свищи и перфорации пищевода, а в последующем развивается медиастинит. Частым осложнением являются аспирационные пневмонии, у ряда больных развиваются экссудативные плевриты как осложнение пневмоний или перфораций пищевода.
При длительном существовании послеожоговых сужений имеется опасность их малигнизации. Все авторы единодушны в том, что при химическом ожоге пищевода вероятность развития рака увеличивается в 10—1000 раз по сравнению со здоровыми лицами. В зонах хронического воспалительного процесса и перестройки эпителия часто возникают пребластоматозные изменения, связанные с очагами избыточной пролиферации клеточных элементов и метаплазии. Сроки от момента возникновения ожога до обнаружения малигнизации разные. Рак пищевода в ожоговых рубцовых стриктурах чаще наблюдается у женщин.
Ранних патогномоничных клинических симптомов малигнизированных рубцовых стриктур практически нет. Только упорная, быстро рецидивирующая дисфагия вплоть до полной непроходимости пищевода, особенно на фоне длительной ремиссии после ожога, усиление болей, внезапное похудание могут свидетельствовать о развитии рака.
Читайте также:
Рекомендуемые страницы:
©2015-2021 poisk-ru.ru
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование.
Дата создания страницы: 2017-07-02
Нарушение авторских прав и Нарушение персональных данных
Источник
Кафедра госпитальной хирургии лечебного факультета НГМИ.
Зав. кафедрой проф. Моргунов Г.А
.
Преподаватель к.м.н. Старостин С.А.
Работа выполнена студентом 18 группы 5 курса лечебного факультета Чириковым Р.А.
Оперативные методы лечения рубцовых стриктур пищевода.
Из всех относительно доброкачественных сужений пищевода чаще всего встречаются стриктуры после ожогов химическими веществами, развивающиеся постепенно в зависимости от количества и концентрации выпитого раствора.
Из других патологоанатомических изменений, обуславливающих сужение просвета пищевода, следует указать на раковые опухоли, туберкулез, сифилис и другие воспалительные процессы острого или хронического характера, заканчивающиеся образованием рубца в стенке пищевода.
Рубцовые стриктуры, как правило, развиваются при нелеченных или неправильно леченных или очень глубоких и обширных поражениях едкими химическими веществами. Клинические проявления стенозирования начинаются с 4-6 недели после ожога и заключаются в прогрессирующих симптомах нарушения проходимости пищевода (дисфагия, рвота пищей и водой, исхудание). Периодически отмечаются эпизоды полной непроходимости в связи с застреванием твердой пищи. Больным с рубцовыми стенозами пищевода для полноценного питания показано наложение гастростомы. Для уточнения уровня и протяженности стеноза, оценки состояния слизистой оболочки проксимального и дистального отделов пищевода проводят рентгенологическое исследование с контрастным веществом и эзофагоскопию. Для контрастирования дистального отдела пищевода бариевую смесь вводят по катетеру, который подтягивают через гастростому до уровня нижней границы стеноза с помощью нити, проведенной через пищевод. Осмотр дистального отдела производят путем эзофагоскопии через гастростому.
Основным методом лечения рубцовых стриктур является бужирование. Наиболее безопасным методом является бужирование полыми рентгенконтрастными бужами по металлической струне-проводнику под рентгентелевизионным контролем. Позднее бужирование следует начинать с введения самого тонкого бужа под контролем эзофагоскопа. Эта манипуляция проводится под наркозом с применением миорелаксантов. Если расширить просвет пищевода не удается, то накладывается гастростома, что позволяет проводить бужирование сверху вниз и наоборот (так называемое «бесконечное бужирование» по Хакеру).
В случае безуспешности бужирования (сохраняющийся стойкий рубцовый стеноз) применяют оперативное лечение – создание искусственного пищевода.
Предоперационная подготовка.
Больные, нуждающиеся в эзофагопластике, как правило, истощены вследствие невозможности нормального питания. Поэтому при подготовке к операции необходима нормализация белкового и водно-электролитного баланса. С этой целью назначается парентеральное питание, которое у ряда больных может быть полным. При невозможности проведения парентерального питания или его неэффективности показана гастростомия. Для подготовке к эзофагопластике применяют антибиотики широкого спектра действия.
Методы эзофагопластики.
Начало создания искусственного пищевода положил Бирхер (H. Bircher, 1894), предложивший формировать пищевод из кожного лоскута, выкраиваемого в области грудины. Эта операция не получила широкого распространения из-за возникновения пептических язв вновь образованного пищевода, тяжелых дерматитов, множественных свищей, злокачественных новообразований и др.
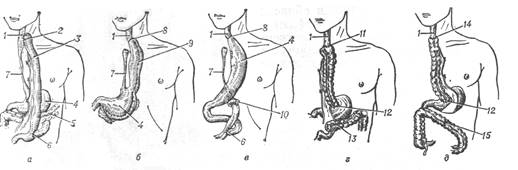
Удаление пораженного пищевода – весьма травматичная операция, чреватая тяжелыми осложнениями. Признано более целесообразным накладывать обходной искусственный пищевод. Для этого используют желудок, тонкую или толстую кишку (рис. 1).

Рисунок 1. Схематическое изображение некоторых способов
создания искусственного пищевода.
а
– с помощью тонкой кишки (по Ру-Герцену-Юдину
); б
– с помощью лоскута, выкроенного из стенки большой кривизны желудка (по Гаврилиу
); в
– с помощью желудка, пересеченного в области кардии (по Киршнеру
); г
– с помощью правой половины поперечно-ободочной кишки (по Ройту
); д
– с помощью левой половины поперечно-ободочной кишки (по Орсони и Тупе
).
1
– проксимальный отдел пищевода, 2
– пищеводно-кишечный анастомоз, 3
– тонкая кишка, 4
– желудок, 5
– поперечно-ободочная кишка, 6
– межкишечный анастомоз, 7
– стриктура пищевода, 8
– пищеводно-желудочный анастомоз, 9
– трансплантат, выкроенный из стенки большой кривизны желудка, 10
– кардиальный отдел желудка, 11
– анастомоз между пищеводом и толстой кишкой, 12
– анастомоз между поперечно-ободочной кишкой и желудком, 13
– илеотрансверзоанастомоз, 14
– анастомоз между желудком и нисходящей частью поперечно-ободочной кишки, 15
– толстокишечный анастомоз.
Решающим успехом этой операции является создание кишечного хорошо васкуляризированного трансплантата нужной длины. У ряда больных из-за особенностей строения сосудистой сети брыжейки тонкой кишки ее не удается мобилизовать. Для создания искусственного пищевода можно использовать толстую кишку. С одинаковым успехом для эзофагопластики применяется правая половина толстой кишки с небольшим участком тощей и левая половина ободочной. Для сегментарной пластики пищевода у некоторых больных успешно применяется центральная часть поперечной ободочной кишки.
Для формирования искусственного пищевода можно использовать большую кривизну желудка.
До начала пятидесятых годов все хирурги вновь созданный искусственный пищевод проводили на шею антеторакально
, позже наряду с этим стали использовать внутригрудной
путь проведения трансплантата. А. Г. Савиных с помощью сагиттальной диафрагмотомии проводил тонкокишечный трансплантат на шею через заднее средостение
. Н.И. Еремеев, Робертсон и Сарджент описали методику загрудинной
пластики пищевода. Внутриплевральная
эзофагопластика была осуществлена С.С. Юдиным, Ринхоффом.
Вопрос о выборе того или иного способа эзофагопластики и пути проведения трансплантата должен решаться сугубо индивидуально в зависимости от общего состояния больного, анатомических особенностей органов брюшной полости, а также характера архитектоники сосудов кишечника.
При рубцовой стриктуре пищевода место расположения трансплантата выбирают в зависимости от уровня стриктуры. При низком ее расположении наиболее рационально внутриплевральное расположение трансплантата, так как при применении пред- и загрудинной эзофагопластики в остающемся слепом мешке пищевода, выше стриктуры, возможно развитие воспаления, рака и других осложнений.
В случае протяженной стриктуры в средней трети грудного отдела пищевода, когда выше и ниже стриктуры просвет пищевода сохранен, показана сегментарная пластика. Для решения вопроса о целесообразности применения сегментарной пластики необходимо исследование дистального отрезка пищевода, для чего применяют ретроградную эзофагоскопию и эзофагографию. Для пластики используют тонкую или толстую кишку, сегмент которой проводят в грудную полость и анастомозируют с пищеводом выше и ниже стриктуры.
Если стриктура распространяется до кардии желудка, то нижний анастомоз накладывают с желудком.
В случае стриктуры шейного отдела пищевода производят его резекцию с последующей эзофагопластикой свободным сегментом тонкой кишки, кровоснабжение которого обеспечивают с помощью анастомоза между сосудами трансплантата и ветвями шейных сосудов.
Аллопластическое замещение пищевода не получило применения в клинической практике.
Послеоперационное ведение.
В первые двое суток питание больных осуществляется парентеральным путем. На 3-4 сутки после операции начинают дополнительное кормление через гастростому. Необходимо следить за жизнеспособностью трансплантата. В случае расположения трансплантата под кожей наблюдение за ним облегчается. Обычно на вторые сутки после операции при легком постукивании пальцами в области расположения трансплантата можно видеть его перистальтику или тоническое сокращение, что указывает на его жизнеспособность. При некрозе кишки возникает вздутие трансплантата на всем протяжении, затем покраснение кожи над кишкой и появляются признаки интоксикации. В сомнительных случаях следует небольшим разрезом кожи обнажить верхний участок трансплантата с целью контроля его жизнеспособности. При расположении трансплантата в загрудинном пространстве или в плевральной полости единственным объективным способом контроля является осмотр трансплантата на шее. В случае обнаружения некроза необходимо удалить весь трансплантат или его часть. После удаления некротизированной кишки средостение следует дренировать со стороны шеи и брюшной полости.
После эзофагопластики могут развиться такие заболевания, как рефлюкс-эзофагит, связанный с отсутствием кардии или нарушением ее сфинктерно-клапанной функции; нарушение проходимости искусственного пищевода вследствие рубцовых изменений в области анастомозов или на почве рефлюкс-эзофагита; дивертикулы искусственного пищевода; язвы трансплантата; свищи, полипоз и редко рак искусственного пищевода.
Источник
