Можно ли принимать лозап плюс при подагре

Статьи
Опубликовано в журнале:
Кардиоваскулярная терапия и профилактика, 2008; 7(2)
А.Е. Ильина, В.Г. Барскова, Е.Л. Насонов
ГУ Институт ревматологии РАМН. Москва, Россия
Losartan therapy in gout patients
A.I. Ilyina, B.G. Barskova, E.L. Nasonov
Rheumatology Institute, Russian Academy of Medical Science. Moscow, Russia
Цель. Изучить эффективность и переносимость лозартана у больных подагрой и артериальной гипертензией (АГ).
Материал и методы. Обследованы 30 пациентов, находящихся в межприступном периоде заболевания. Средний возраст больных 49,8±10,5 лет, продолжительность заболевания – 6,5 (3,0;16) года. В течение 8 недель изучалась антигипертензивная и урикозурическая активность лозартана, оценивались побочные эффекты.
Результаты. Систолическое артериальное давление снизилось на 15,4%, диастолическое – на 14,3%, мочевая кислота сыворотки снизилась на 9%, урикозурия возросла на 14%. Побочных эффектов препарата зарегистрировано не было. У пациентов отсутствовали признаки развития артрита.
Заключение. Лозартан может быть рекомендован для лечения АГ у больных подагрой.
Ключевые слова: подагра, гиперурикемия, артериальная гипертензия, лозартан.
Aim. To study losartan effectiveness and safety in patients with gout and arterial hypertension (AH).
Material and methods. In total, 30 patients not having goat attack were examined (mean age 49,8±10,5 years, disease duration – 6,5 (3,0;16) years). For 8 weeks, antihypertensive and uricosuric activity of losartan, as well as its adverse effects, were examined.
Results. Blood pressure normalized in 63% of the participants, serum uric acid level decreased by 9%, and uricosuria increased by 14%. No adverse effects or arthritic s were registered.
Conclusion. Losartan could be ed for treating AH in gout patients.
Key words: Gout, hyperuricemia, arterial hypertension, losartan.
Подагра – системное тофусное заболевание, характеризующееся отложением кристаллов моноурата натрия (МУН) в различных тканях и развивающимся в связи с этим воспалением, у лиц с гиперурикемией (ГУ), обусловленной внешнесредовыми и/или генетическими факторами [1]. Эпидемиологические данные свидетельствуют об увеличении распространенности болезни [2]. В ряде работ показано, что заболеваемость подагрой удвоилась за последние 10-20 лет [3,4]. Считается, что не менее 1% мужчин в странах Запада страдают подагрой [5-8], которая является одной из самых частых причин воспаления суставов у мужчин среднего возраста [3, 9].
В настоящее время доказано, что ГУ ассоциирована с дислипидемией, артериальной гипертензией (АГ), сахарным диабетом, инсулинорезистентностью, ожирением и связанными с атеросклерозом сердечно-сосудистыми заболеваниями (ССЗ) [10-19]. Ведущей причиной смерти больных подагрой являются кардиоваскулярные нарушения, обусловленные атеросклеротическим поражением сосудов [20,22]. Известно, что ГУ и АГ тесно связаны между собой [28-31]. Хотя патогенетические механизмы, с помощью которых мочевая кислота (МК) может участвовать в развитии ССЗ, до конца не ясны, известно, что ГУ оказывает неблагоприятное влияние на эндотелиальную функцию, усиливает адгезию и агрегацию тромбоцитов [30], может приводить к увеличению уровня воспалительных медиаторов, индуцировать пролиферацию сосудистых гладкомышечных клеток in vitro [42], активируя факторы транскрипции и сигнальные молекулы, вызывая гиперэкспрессию циклооксигеназы, тромбоцитарного фактора роста и моноцитарного хемоаттрактантного белка. Показано, что больные АГ и ГУ имеют в 3-5 раз больший риск развития ишемической болезни сердца или цереброваскулярных болезней по сравнению с пациентами с нормоурикемией [34]. Исследование LIFE (Losartan Intervention For Endpoint reduction in hypertension) продемонстрировало уменьшение кардиоваскулярного риска у больных с АГ и гипертрофией левого желудочка (ГЛЖ) при медикаментозном снижении содержания МК в сыворотке крови [35].
По данным литературы частота АГ у больных подагрой колеблется от 36% до 41%, а в сочетании с метаболическим синдромом (МС) увеличивается до 72% [22-26]. По данным Института ревматологии РАМН АГ страдают > 80% пациентов с подагрой [18,27]. В связи с этим контроль АГ является важной частью терапии больных подагрой. Учитывая высокое распространение метаболических нарушений у этой группы пациентов, важно отсутствие негативного влияния лекарств на углеводный, липидный и другие виды обмена. Перспективным является поиск препаратов, обладающих дополнительным урикозурическим эффектом. В этом отношении особый интерес представляет антагонист ангиотензина II (АТ II) лозартан. Способность лозартана усиливать экскрецию МК впервые была описана в 1992г [33]. Исследования показали, что урикозурическая активность лозартана – следствие особенностей молекулярной структуры исходной молекулы, а не механизма его действия (блокады АТ1-рецептора) [32]. Другие блокаторы АТ1 рецепторов, так же как и ингибиторы ангиотензин-превращающего фермента (ИАПФ), не обладают урикозурическим эффектом. Лозартан вызывает умеренное повышение экскреции МК, составляющее, по данным разных авторов, от 3% до 30% [36-39]. Снижение уровня МК происходит медленно, что предотвращает возможное развитие обострений суставного синдрома у больных подагрой [40]. Применение лозартана вызывает увеличение рН мочи, что может предотвращать осаждение МК и камнеобразование в почках и мочевых путях [38]. Целью настоящего исследования явилось изучение эффективности и переносимости монотерапии лозартаном больных подагрой.
Материал и методы
Обследованы 30 мужчин с достоверным диагнозом подагры по критериям Wallace SL 1977 [40], страдающих АГ. Возраст больных составил 32-70 лет (средний возраст 49,8±10,5), продолжительность болезни (медиана и интерквартильный размах) – 6,5 (3,0;16) года. 43% пациентов имели внутрикожные и подкожные тофусы. У 70% пациентов диагноз подтвержден обнаружением кристаллов МУН. На момент исследования больные находились в межприступном периоде (> 2 недель после купирования артрита). В исследование включали пациентов, ранее не принимавших антигипертензивные и антигиперурикемические препараты. У 60% больных имела место АГ I, у 33% – II и у 7% – III степени (ст.) тяжести согласно классификации по уровню АД, принятой ВОЗ/МОАГ 1999 [41]. Среднее по группе систолическое артериальное давление клиническое (САД кл.) составило 154,2±11,2 мм рт.ст., диастолическое (ДАД кл.) – 95,6±7,4 мм рт.ст. Пациентам назначали лозартан (Лозап®, ЗЕНТИВА, Чешская Республика) в дозе 50 мг/сут. однократно утром. Если через 2 недели терапии снижение АД оказывалось не достаточным, доза удваивалась. Длительность наблюдения – 8 недель. Исходно и через 8 недель терапии всем больным выполняли биохимическое исследование крови с определением: глюкозы, холестерина (ХС), креатинина, мочевины, МК, аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), γ-глутамилтранспептидазы (γ-ГТП) и анализ суточной урикозурии. Врачом во время визитов больного (исходно, через 2, 4 и 8 недель лечения) измерялось АД кл., оценивалось состояние больного (наличие артритов) и регистрировались побочные явления. АД кл. определяли как среднее 3 измерений АД ручным сфигмоманометром в положении сидя после 5-минутного отдыха. На протяжении всего исследования пациенты осуществляли самоконтроль АД. За критерий эффективности антигипертензивной терапии по АД кл. принимали снижение ДАД кл. на 10% или на 10 мм рт.ст. и САД кл. – на 15 мм рт.ст. от исходного уровня. Целевым уровнем АД кл. на фоне терапии считали АД < 140/90 мм рт.ст.
Статистическая обработка данных проводилась с помощью программы ISTICA 6.0 (soft, США). Рассчитывались описательные статистики; для оценки динамики показателей на фоне лечения применялся парный непараметрический метод анализа по Вилкоксону. Результаты представлены в виде средней (М) и стандартного отклонения (SD). За статистически значимые принимались отличия на уровне р<0,05.
Результаты и обсуждение
За время исследования побочных эффектов препарата зарегистрировано не было. У пациентов не отмечалось развития артрита. Через 2 недели терапии Лозапом® в дозе 50 мг/сут. АД кл. снизилось со 154,2±11,2/95,6±7,4 до 136,3±11,9/ 86,3±7,4 мм рт.ст. – ДАД кл.=-17,9±8,3/-9,2±8,1 мм рт.ст. (р<0,001). К 8 неделе лечения произошло дополнительное снижение АД кл. со 136,3±11,9/86,3±7,4 до 130,5±10,4/81,9±5,7 мм рт.ст. – ДАД кл.=-5,8±9,2/-4,4±5,9 мм рт.ст. (р<0,01) (рисунок 1). Средний уровень МК сыворотки крови до начала терапии составил 471,6±85,3, к концу исследования – 428,5±85,4 мкмоль/л; в целом по группе произошло снижение МК сыворотки на9% (рисунок 2). Средняя концентрация МК в моче за время исследования возросла на 14% – с 3,6±1,7 мкмоль/л до 4,2±2,7 мкмоль/л (рисунок 3). В таблице 1 приведены результаты биохимического анализа крови до и после приема лозартана. За время приема препарата уровень глюкозы крови не менялся. Появилась тенденция к улучшению показателей липидного обмена – некоторое снижение общего холестерина (ОХС), триглицеридов (ТГ) и повышение ХС липопротеинов высокой плотности (ЛВП). За время исследования не выявлено существенных изменений показателей, отражающих функцию печени и почек.
Рис. 1 Динамика АД на фоне лечения.
Рис. 2 Динамика уровня МК в сыворотке крови.
Рис. 3 Динамика уровня урикозурии.
Таблица 1. Динамика показателей биохимического анализа крови
| Показатель | До назначения препарата | Через 8 недель лечения |
| Креатинин, мкмоль/л | 99,0±15,7 | 94,6±13,7 |
| Мочевина, ммоль/л | 4,3±1,3 | 4,2±1,3 |
| Глюкоза, ммоль/л | 5,4±0,6 | 5,4±0,4 |
| ОХС, ммоль/л | 7,2±1,5 | 6,9±1,6 |
| ТГ, ммоль/л | 1,5±0,6 | 1,3±1,1 |
| ХС ЛВП, ммоль/л | 1,2±0,3 | 1,5±0,3 |
| АЛТ, ед. | 34,0±15,7 | 37,9±24,9 |
| АСТ, ед. | 24,3±10,8 | 22,4±7,8 |
| γ-ГТП, ед. | 87,7±91,3 | 88,9±108,6 |
Таким образом, поскольку АГ встречается у большинства больных подагрой, коррекция АД является важным компонентом терапии. При этом предпочтение отдается метаболически нейтральным и снижающим МК препаратам. По данным литературы, лозартан способен повышать экскрецию МК на 3%-30% [36-39], что согласуется с результатами настоящего исследования. Следует отметить, что лозартан предложен экспертами Европейской лиги ревматологов в качестве препарата выбора в лечении больных подагрой благодаря своему гипоурикемическому эффекту [41]. Урикозурическое действие лозартана может помочь уменьшить дозу аллопуринола или избежать его назначения у ряда больных, а также снизить количество назначаемых препаратов и увеличить приверженность пациентов лечению. Результаты настоящего исследования свидетельствуют о хорошей переносимости препарата и отсутствии обострения суставного синдрома. Таким образом, лозартан может быть рекомендован для лечения АГ у больных подагрой.
Литература
1. Насонова В.А., Барскова В.Г. Ранние диагностика и лечение подагры – научно обоснованное требование улучшения трудового и жизненного прогноза больных. Научно-практическая ревматология 2004; 1: 5-7.
2. Arromdee E, Michet CJ, Crowson CS, et al. Epidemiology of Gout: Is the Incidence Rising? J Rheumatol 2002; 29: 2403-6.
3. Wallace KL, Riedel AA, Joseph-Ridge N, Wortmann R. Increasing prevalence of gout and hyperuricemia over 10 years among older adult in a managed care population. J Rheumatol 2004; 31: 1582-7.
4. Adams PF, Hendershot GE, Marano MA. Current estimates from the National Health Interview Survey, 1996. Vital Health 10 1999; 200 р.
5. Lawrence RC, Helmick CG, Arnett FC, et al. Estimates of the prevalence of arthritis and selected musculoskeletal disorders in the United es. Arthritis Rheum 1998; 41: 778-99.
6. Saag KG, Mikuls TR. Recent advances in the epidemiology of gout. Curr Rheumatol Rep 2005; 7: 235-41.
7. Terkeltaub RA. Clinical practice. Gout. N Engl J Med 2003; 349: 1647-55.
8. Roubenoff R, Klag MJ, Mead LA, et al. Incidence and risk factors for gout in white men. JAMA 1991; 266: 3004-7.
9. Ланг Г.Ф. Гипертоническая болезнь. Москва 1950.
10. Гудцент Ф. (Gudzent F.) Подагра и ревматизм. Пер. с нем. М.-Л. 1931.
11. Мясников А.Л. Атеросклероз. Москва 1960.
12. Тареев Е.М. Внутренние болезни. Москва 1956.
13. Тареев Е.М. Гипертоническая болезнь. Москва 1948.
14. Vague J. The degree of masculine differentiation of obesities, a factor determining predisposition to diabetes, atherosclerosis, gout uric calculous disease. Am J Clin Nulr 1956; 4(2): 2034.
15. Myers A, Epstein FH, Dodge HJ, et al. The relationship of serum uric acid to risk factors in coronary heart disease. Am J Med 1968; 45: 520-8.
16. Camus JP. Goutte, diabete, hyperlipemie: un trisyndrom bolique. Rev Rhumatol 1966; 33: 10-4.
17. Барскова В.Г. Метаболический синдром и кардиоваскулярные нарушения при подагре. Автореф дис докт мед наук. Москва 2006.
18. Vazguez-Mellado J, Garsia CG, Vazguez SG, et al. bolic syndrome and ischemic heart disease in gout. J Clin Rheumatol 2004; 10(3): 105-9.
19. Gutman AB. Views on the pathgenesis and management of primary gout – 1971. J Bone Joint Surg 1972; 54A: 357-72.
20. Radic MT, Valkenburg HA, Davidson RT, et al. Observations on the natural history of hyperuricemia and gout. I. An eighteen year follow-up of nineteen gouty families. Am J Med 1964; 37: 862-71.
21. Nakagawa T, Mazzali M, Kang D-H. Hyperuricemia Causes Glomerular Hypertrophy in the Rat. Am J Nephrol 2003; 23(1): 2-7.
22. Mazzali M, Hughes J, Kim YG, et al. Elevated uric acid increases blood pressure in the rat by a novel crystal-independent mechanism. Hypertension 2001; 38: 1101-6.
23. Alderman M, Aiyer KJV. Uric acid: role in CVD and effects of losartan. Curr Med Res Opin 2004: 20(3): 369-79.
24. Johnson RJ, Kang D-N, Feig D, et al. Is there a pathogenetic role for uric acid in hypertension and cardiovascular and renal disease? Hypertension 2003; 41: 1183-90.
25. Leyva F, Anker S, Godsland IF, et al. Uric acid in chronic heart failure: a marker of chronic inflammation. Eur Heart J 1998; 19: 1814-22.
26. Rao GN, Corson MA, Berk BC. Uric acid stimulates vascular smooth muscle cell proliferation by increasing platelet-derived growth factor A-chain expression. J Biol Chem 1991; 266: 8604-8.
27. Breckenridge A. Hypertension and hyperuricemia. Lancet 1966: 1: 15-8.
28. Dahlof B, Devereux RB, Kjeldsen SE, et al. Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomised trial against atenolol. Lancet 2002; 359: 995-1003.
29. Weiss TE, SegaloffA. Gouty Arthritis and Gout. Springfield, III, Thomas 1959; 7 p.
30. Wyngaarden JB, Kelley WN. Gout and hyperuricemia. New York 1976; 512 р.
31. Kuzell WC, Schaffarzick RW, Naugler WE, et al. Some observations on 520 gouty patients. J Chronic Dis 1995; 2: 645-69.
32. Ильиных Е.В. Факторы риска развития кардиоваскулярных заболеваний у больных подагрой. Автореф дис канд мед наук. Москва 2006.
33. Nakashima M, Uematsu T, Kosuge K. Pilot study of the uricosuric effect of DuP-753, a new angiotensin II receptor antagonist, in healthy subjects. Eur J Clin Pharmacol 1992; 42(3): 333-5.
34. Sweet CS, Bradstreet DC, Berman RS, et al. Pharmacodynamic activity of intravenous E-3174, an angiotensin II antagonist, in patients with essential hypertension. Am J Hypertens 1994; 7(12): 1035-40.
35. Burnier M, Roch-Ramel F, Brunner HR. Renal effects of angiotensin II receptor blocade in normotensive subjects. Kidney Int 1996; 49: 1787-90.
36. Grossman E, Peleg E, Caroll J, et al. Hemodynamic and humoral effect of the angiotensin II receptor antagonist losartan in essential hypertension. Am J Hypertens 1994; 7: 1041-4.
37. Shaninfar S, Simpson RL, Carides AD, et al. Safety of losartan in hypertensive patients with thiazide induced hyperuricemia. Kidney Int 1999; 56: 1879-95.
38. Bardin T. Fenofibrate and losartan. Ann Rheum Dis 2003; 62: 497-8.
39. Liberopoulos E, Christed D, Elisaf M. Comparative effects of losartan and irbesartan on serum uric acid in hypertensive patients with hyperuricaemia and gout. J Hypertens 2002; 20(2): 347.
40. Wallace SL, Robinson H, Masi AT, et al. Preliminary criteria for the classification of the acute arthritis of gout. Arthritis Rheum 1977; 20: 895-900.
41. Артериальная гипертония (Рекомендации ВОЗ и МОАГ). Москва 1999; 18 c.
42. Zhang W, Doherty M, Bardin T, et al. EULAR evidence based ations for gout. Part II: Management. Report of a task force of the EULAR Standing Committee For International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 2005; 65(10): 1312-24. Комментарии к статье Г.Г. Еремушкина “Терминологические аспекты оценки артериального давления”
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
Внастоящее время подагра рассматривается как важная общемедицинская проблема, что связано не только с увеличением распространенности болезни, но и с полученными данными о влиянии гиперурикемии на прогрессирование атеросклеротического поражения сосудов [1, 2]. По мнению экспертов, подагра является метаболическим заболеванием [3, 4], а гиперурикемия — одним из важнейших компонентов метаболического синдрома. Еще в 60-е годы прошлого века была обнаружена тесная взаимосвязь между нарушениями пуринового обмена и гипертриглицеридемией [6]. По результатам 8-летнего исследования доказана связь между гиперурикемией и инсулинорезистентностью [5]. Гиперурикемия является независимым фактором риска сердечно-сосудистых заболеваний [1, 2, 7], поэтому диагностика и лечение подагры, гиперурикемии, а также осложнений заболевания являются актуальной проблемой терапии.
Помимо непосредственного патологического влияния повышенного уровня мочевой кислоты на стенку сосудов важное значение у больных подагрой приобретает воздействие повышенного артериального давления (АД), которое чрезвычайно часто встречается у данной категории пациентов [8]. Артериальная гипертензия (АГ), в свою очередь, значительно увеличивает риск кардиоваскулярных катастроф [8, 9]. Актуальной проблемой является применение патогенетически обоснованной, безопасной гипотензивной терапии, обеспечивающей адекватный контроль АД в течение суток. У больных подагрой, страдающих АГ, необходимо учитывать взаимосвязь сложных метаболических процессов, чтобы не увеличить риск терапевтически-индуцированной подагры [3]. Важнейшее значение приобретает метаболическая безопасность препаратов, применяемых для лечения АГ у больных подагрой. Под метаболической нейтральностью препаратов понимают влияние их не только на липидный и углеводный обмен, но и на уровень мочевой кислоты [3]. Кроме того, адекватная гипотензивная терапия подразумевает выбор препарата, обладающего возможностью дополнительного снижения риска сердечно-сосудистых осложнений, уменьшения выраженности эндотелиальной дисфункции. Далеко не все препараты, входящие в стандарты лечения сердечно-сосудистых заболеваний, удовлетворяют этим условиям у пациентов, страдающих подагрой. Так, диуретики считаются средствами первого ряда для длительной терапии больных с АГ. Все классы мочегонных препаратов противопоказаны при подагре. Показано, что не существует безопасного класса диуретиков. Все препараты данной группы ингибируют экскрецию мочевой кислоты, приводя к гиперурикемии; β-адреноблокаторы также не являются препаратами выбора при сочетании подагры и АГ, так как они увеличивают инсулинорезистентность, гиперинсулинемию, усугубляя гиперурикемию [4].
В настоящее время известно, что метаболически нейтральными препаратами, обеспечивающими оптимальный контроль АД, являются антагонисты кальция дигидропиридинового ряда длительного действия (амлодипин), ингибиторы ангиотензинпревращающего фермента [4], блокатор АТ1-рецепторов ангиотензина II (лозартан) [10]. Среди указанных групп препаратов особое место принадлежит антагонистам кальция. Механизм действия связан с блокированием медленных кальциевых каналов и препятствованием внутриклеточной гиперкальциемии, с расслаблением гладких мышц и снижением периферического сосудистого сопротивления. Период полувыведения амлодипина равен 35–50 ч. В многочисленных многоцентровых исследованиях (NORDIL, INSIGHT, VHAT, HOT, ALLHAT) показано снижение риска сердечно-сосудистых осложнений на фоне терапии антагонистами кальция пролонгированного действия. Неоспоримым преимуществом препаратов является возможность использования их у пациентов с метаболическим синдромом, так как они не обладают отрицательным влиянием на углеводный, липидный, пуриновый обмены [11, 12].
Несмотря на большое количество исследований, посвященных диагностике, тактике выбора препаратов при АГ, вплоть до настоящего времени недостаточно данных об особенностях суточного профиля АД у больных подагрой, влиянии пролонгированных антагонистов кальция при сочетании подагры и АГ.
Целью нашего исследования явилось изучение циркадных ритмов АД, эффективности применения амлодипина при сочетании подагры и АГ.
Материал и методы
В исследование были включены 40 больных первичной подагрой — основная группа (ОГ) (32 мужчины и 8 женщин), средний возраст 52,88 ± 2,08 года (от 30 до 76 лет). Диагноз подагры был определен на основании классификационных критериев, предложенных Wallace и соавторами, рекомендованных ARA в 2001 г. Критериями невключения являлись наличие ассоциированных с АГ состояний (в том числе сахарный диабет, ишемическая болезнь сердца), сопутствующие хронические болезни в стадии обострения, острый приступ подагрического артрита. Все обследованные пациенты страдали АГ (длительность болезни от 1 года до 30 лет), риск был расценен как высокий и очень высокий.
Группу сравнения (ГС) составили 20 пациентов с артериальной гипертензией, сопоставимых по возрасту, полу, сопутствующей патологии. В контрольную группу (КГ) было включено 20 клинически здоровых лиц. Всем обследованным лицам проводилось общеклиническое исследование, суточное мониторирование АД в условиях стационара, определение антитромбогенной активности сосудистой стенки.
У больных подагрой проводились исследования, необходимые для подтверждения диагноза, выявления особенностей течения заболевания, поражения различных органов и систем (мочевая кислота сыворотки крови и суточной мочи, рентгенография пораженных суставов, пункция суставов, ультразвуковое исследование почек). Наиболее часто поражались суставы нижних конечностей. У подавляющего большинства больных (87%) вовлечение суставов начиналось с артрита плюснефалангового сустава I пальца стопы. Средняя длительность заболевания составила 9,65 ± 2,03 года (от 0,6 до 32 лет), обращались к врачу в среднем на 10 год болезни. У 68% пациентов диагностирована тофусная подагра, к которой относили подкожные, внутрикостные тофусы (симптом «пробойника»), нефролитиаз. Гиперурикемия выявлена у 73% больных подагрой. Артериальная гипертензия у данной категории пациентов клинически отличалась малосимптомностью, в связи с чем более половины пациентов не контролировали АД и не принимали регулярно гипотензивные препараты. На амбулаторном этапе 46% обследованных больных подагрой с гипотензивной целью принимали иАПФ, антагонисты кальция, адреноблокаторы, диуретики (10%), комбинированные препараты, на фоне терапии целевой уровень АД был достигнут лишь у 15% больных.
При поступлении в стационар всем обследованным лицам проводилось суточное мониторирование АД с частотой 15 мин в дневные часы и 30 мин в ночные часы. Оценивались следующие показатели: среднее АД, максимальное, минимальное АД, вариабельность АД, гипертонический индекс времени АД. Все параметры определялись как для систолического АД (САД), так и для диастолического АД (ДАД).
Всем пациентам в качестве гипотензивной терапии назначался амлодипин (Амловас) в начальной дозе 5 мг/сут. Титрование дозы препарата проводилось через 3–5 дней пребывания в стационаре с увеличением до 10 мг/сут при необходимости или комбинирование с иАПФ. Через 3 месяца регулярного приема гипотензивных препаратов проводилось повторное суточное мониторирование АД. В течение этого времени контроль эффективности терапии, наличия побочных эффектов осуществлялся при ежемесячных визитах пациентов.
Статистический анализ проводился с помощью пакета прикладных программ ISTICA 6.0, описательной статистики. Результаты расценивались как статистически значимые при величинах достигнутого уровня достоверности (p) менее 0,05.
Результаты
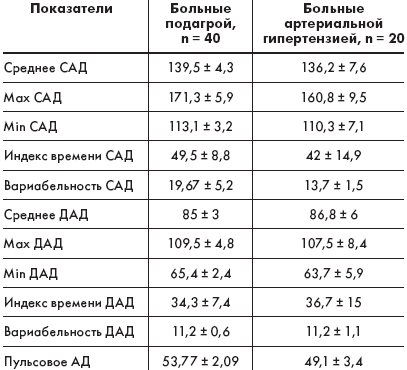
Усредненные данные суточного мониторирования АД у больных подагрой и пациентов, страдающих АГ, представлены в табл.
У больных подагрой отмечены более высокие показатели среднего систолического, диастолического, пульсового АД, максимального и минимального АД, индекса времени гипертензии, вариабельности АД, хотя данные различия по сравнению с аналогичными параметрами у лиц группы сравнения не достигали статистически значимых.
Однако существенные отличия были в степени снижения АД в ночное время. Так, у большинства больных подагрой (73,7%) выявлен суточный профиль с недостаточной степенью снижения АД (Non-dipper), у 21% пациентов регистрировалось устойчивое повышение АД в ночные часы (Night-peaker), нормальную степень снижения АД имели лишь 5% больных (Dipper). Тогда как у больных АГ преимущественно (62,5%) наблюдался профиль Dipper, в 25% случаев — Non-dipper, у 12,5% пациентов — Night-peaker. Таким образом, среди больных подагрой достоверно чаще регистрировался профиль Non-dipper по сравнению с лицами, страдающими АГ (р < 0,01).
При анализе эффективности терапии амлодипином (Амловас) АГ у больных подагрой следует отметить, что все пациенты указывали на достаточно высокую эффективность препарата по субъективным ощущениям и казуальным измерениям АД. Самостоятельно отменил препарат единственный больной в связи с возникновением ощущения «сердцебиения» через 2 суток от момента приема амлодипина. Других возможных побочных эффектов в наблюдаемой группе пациентов не было. У 18 (45%) больных целевой уровень АД был достигнут в течение 4–6 дней на фоне монотерапии — приема 5 мг препарата в сутки.
У остальных 22 (55%) больных через 4–6 дней от начала приема амлодипина (Амловас) не был достигнут целевой уровень АД, что потребовало увеличения дозы до 10 мг/сут. Через 3–4 дня от момента увеличения дозы препарата при контроле эффективности проводимой терапии нормализация АД была отмечена у 19 (47,5%) пациентов, т. е. АД стабилизировалось через 7–10 дней от начала приема препарата. У 7,5% (3) пациентов не удалось достичь целевых значений АД в течение 7–10 дней, в связи с этим была рекомендована комбинированная гипотензивная терапия (амлодипин и иАПФ — эналаприл).
В дальнейшем после выписки из стационара при ежемесячных визитах проводилось измерение АД. На фоне приема рекомендованной гипотензивной терапии у 29 (73%) пациентов АД было в пределах целевых значений, у 10 (25%) — в пределах высокого нормального АД. Все больные отмечали хорошую переносимость препарата Амловас.
Через 3 месяца терапии по результатам проведенного суточного мониторирования АД достоверно снизились показатели среднего САД и ДАД, пульсового АД, уменьшился индекс времени гипертензии. Однако не было получено статистически значимых отличий изменения суточного профиля АД, что, возможно, связано с недостаточно длительным приемом амлодипина.
Выводы
Больные подагрой, страдающие артериальной гипертензией вследствие малосимптомности повышенного АД, высокой социальной активности, наличия суставного синдрома, отличаются низкой приверженностью к гипотензивной терапии.
У больных подагрой есть нарушения циркадного ритма АД, что проявляется в большинстве случаев в недостаточной степени снижения АД в ночные часы. Нарушение суточного профиля АД является дополнительным фактором риска кардиоваскулярных осложнений [13].
Таким образом, у больных подагрой, страдающих АГ, по сравнению с пациентами с эссенциальной АГ, существуют дополнительные факторы риска кардиоваскулярных событий в виде нарушения суточного профиля АД. Учитывая малосимптомность, низкую приверженность к гипотензивной терапии, эффективность, хорошую переносимость, метаболическую нейтральность, а также безопасность применения, препаратами выбора у пациентов с АГ в сочетании с подагрой являются пролонгированные антагонисты кальция (амлодипин).
По вопросам литературы обращайтесь в редакцию.
А. П. Ребров, доктор медицинских наук, профессор
Н. А. Магдеева
СГМУ, Саратов
Источник
