Изменения в крови при ожогах


Лабораторная диагностика ожоговой болезни

Изменение содержания общих липидов и липопротеидов крови • Первоначально: ↑ мобилизации резервных жиров из жировых депо, поступление их в кровь → ↑ содержания общих жиров в плазме крови. • Этому способствуют: 1. Усиление О-В процессов вследствие ожоговой травмы; 2. ↓ активности липопротеиновой липазы → нарушается переход жирных кислот из хиломикронов плазмы крови в жировые депо; 3. Раздражение симпатического отдела автономной нервной системы → повышенное освобождение из нервных окончаний катехоламинов ( в частности, адреналина, который стимулирует образование аденилатциклазы, а через нее – синтез ц. АМФ, активирующей гормончувствительную липазу).

• Поступление большого количества свободных жирных кислот из крови в печень индуцирует повышение интенсивности процессов ресинтеза триглицеридов и образования ЛПОНП, которые вновь поступают в кровь для последующего транспортирования в ткани. • Т. о. , при ожоговой болезни в начальные периоды в плазме увеличивается содержание ЛПОНП, вызванное мобилизацией резервных жиров из жировых депо.

• Однако при недостатке холестерина и лецитина часть триглицеридов не включается в белково-липидные комплексы, а накапливается в печени в свободном виде. Это ведет к жировой инфильтрации печени, которая может перейти в запущенных и тяжелых случаях в жировое перерождение печени.

• Этому процессу способствует: 1. Гипоксия и истощение запаса углеводов в печени → ↓ скорости синтеза фосфолипидов при усилении мобилизации депонированных жиров; 2. Дефицит белков в организме и использование некоторых аминокислот (метаболизм которых связан с образованием ацетил-Ко. А) для липогенеза; 3. Ограничение обменной мощности цикла Кребса, в результате чего ацетил-ifo. А, интенсивно образующийся при липолизе, в меньшей степени подвергается дальнейшему окислению и поэтому используется на биосинтез нейтральных жиров; 4. Снижение гликогенобразовательной функции печени.
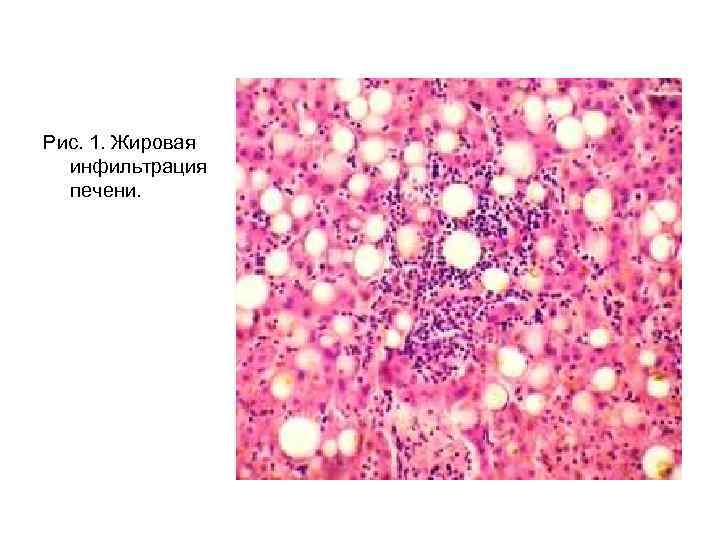
Рис. 1. Жировая инфильтрация печени.

• Но повышение содержания липидов в крови характерно только для ранних стадий ожоговой болезни. Затем развиваются обратные процессы: наступает истощение жировых депо, снижается поступление свободных жирных кислот в кровь и печень, поэтому нарушается синтез триглицеридов и ЛПОНП (в результате снижения интенсивности синтеза фосфолипидов и холестерина, являющихся компонентами липопротеидов).

• При этом экзогенные жиры не могут полностью обеспечить удовлетворение потребностей организма, т. к. из-за нарушения работы пищеварительного тракта они очень плохо усваиваются в желудке и кишечнике. Развивается гиполипидемия.

• Таким образом, уровень содержания отдельных фракций липидов и липопротеидов в крови находится в динамическом равновесии с содержанием таковых в тканях и внутренних органах (особенно в печени). Нарушения работы отдельных звеньев этой цепи приводят к резким сдвигам жирового метаболизма, что отражается на состоянии печени и приводит к ее различным морфофизиологическим изменениям.

Изменения обмена белков и аминокислот • При ожоговой болезни развивается белковая недостаточность. ПРИЧИНЫ: 1) Основной причиной белкового дефицита считается потеря белка в области раны. Механизм: 1. Клетки капилляров обожженной области становятся столь же проницаемыми для молекул белков, как и нормальные капилляры для ионов.

Такое увеличение проницаемости стенки сосудов принято связывать с системой гиалуроновой кислоты и активацией гиалуронидазы. Кроме того, по некоторым данным, при ожоге содержание белковых фракций, влияющих на проницаемость капилляров, в коже резко снижается, в то время как в крови и лимфе оно возрастает.

Это свидетельствует о повышении проницаемости сосудистой стенки капилляров во всем организме, что индуцирует выход белка за пределы сосудистого русла и в необожженных областях. 2. Через 24 -48 часов после ожога плазмопотеря резко уменьшается. Она заменяется обильной экссудацией кожи, которая возникает в результате развития в ней воспалительной реакции и сопровождается постоянной потерей белка через раневую поверхность.

2) Существенной причиной белкового дефицита является усиленный генерализованный распад белка в организме. Это непосредственно связано с нарушением аминокислотного обмена при ожоговой болезни. Было замечено, что в начальные периоды заболевания распад белков идет, как правило, полностью (до аминокислот). В более поздние периоды процессы распада носят незавершенный характер – в результате образуются преимущественно пептидные фрагменты, а не свободные аминокислоты.

3) Кроме того, имеют место специфические расстройства обмена отдельных аминокислот. Особую роль играет нарушение процессов окисления циклических аминокислот (фенилаланина, триптофана, тирозина и др. ). 4) Также в качестве дополнительного пути потери белка выступает усиление его экскреции с мочой в результате нарушения проницаемости стенок почечных канальцев.

5) Нарушения синтеза белка, обусловленные снижением пептической активности желудочного сока, а также сдвигами функционального состояния печени. • Возникает изменение содержания различных фракций белка уже в первые часы после ожога. Альбумины. Характерно абсолютное снижение содержания альбуминов в плазме, которое достигает своего максимума на 10 -15 день заболевания, после чего их концентрация начинает постепенно возрастать (через 2 недели), но длительное время не достигает нормы. Причем ограниченные глубокие ожоги сопровождаются более значительным падением концентрации альбуминов в крови, чем обширные оверхностные ожоги.

α 1 – и α 2 -глобулины. Характерно быстрое нарастание как абсолютного, так и относительного их количества в плазме крови. Причем концентрация α 1 -глобулинов повышается быстрее, достигая своего максимума уже на 5 -7 день болезни, но она раньше начинает снижаться. Содержание α 2 -глобулинов дает наибольший подъем к 7 -15 дню. Далее концентрация этих фракций начинает постепенно снижаться и достигает нормы при выздоровлении.

β-глобулины. Их содержание колеблется в пределах нормы. γ- глобулины. Их концентрация до пятого дня болезни находится в пределах нормы, затем начинает быстро возрастать и достигает максимального значения на 15 й день заболевания. В последующем она держится на этом уровне. Функция γ- глобулинов – защитная, они удаляют из крови различные ожоговые токсины и защищают организм от проникновения патогенной макрофлоры.

Нарушения углеводного обмена • В первые часы ожоговой болезни развивается гипергликемия и глюкозурия. Затем с развитием ожоговой инфекции и токсемии происходит снижение уровня сахара в крови и исчезновение глюкозурии. В некоторых случаях наблюдается вторая волна гипергликемии.

• При развитии ожогового истощения снова наступает патологическое снижение уровня глюкозы. Это связано с длительным угнетением работы коры надпочечников и с активацией функционирования инсулярного аппарата поджелудочной железы. В период реконвалесценции количество сахара в крови возвращается к норме, что сопровождается нормализацией глюкокортикоидной функции коры надпочечников.

• В момент термической травмы в организме выделяется большое количество катехоламинов. Происходит активация расщепления гликогена в печени за счет перехода фосфорилазы В в фосфорилазу А, происходящего под действием адреналина. Поэтому в течение первых нескольких часов после травмы организм может поддерживать необходимый уровень глюкозы в крови до тех пор, пока запасы гликогена в печени (около 200 г) не будут исчерпаны.

• Далее для поддержания необходимого уровня гликемии будут активироваться резервные механизмы, основанные на глюконеогенезе. Причем источником для синтеза глюкозы в этом случае являются аминокислоты белков мышечных клеток, имеющие разветвленную цепь: валин, изолейцин, лизин.

• Несмотря на повышение интенсивности синтеза инсулина степень утилизации глюкозы тканями в посттравматическом периоде снижается. Это объясняется взаимодействием продуктов распада с инсулиновыми мембранными рецепторами, которые в результате этого теряют способность реагировать с молекулами инсулина, а также нарушениями пострецепторного звена. Измененный инсулиновый ответ тканей также может быть результатом активации гипоталамо- гипофизарной системы в результате стресса, в связи с чем в первые часы после травмы повышается продукция стероидов.

• Такая недостаточная утилизация глюкозы тканями и невозможность использования ее в качестве источника энергии для клеток приводит к дальнейшему разрушению аминокислот, с помощью которого поддерживается достаточный уровень энергообеспечения организма.

Нарушение работы цикла Кребса при ожоговой болезни. • При ожогах содержание цитрата в печени уменьшается, что свидетельствует о снижении интенсивности синтеза лимонной кислоты. Это является следствием уменьшения окислительного декарбоксилирования пирувата, а также нарушения цитратсинтазной реакции.

• Уменьшение содержания цитрата сказывается на следующих процессах: 1. Перенос водорода в различных биосинтетических реакциях; 2. Восстановление НАД в изоцитратдегидрогеназной реакции; 3. Аллостерическая регуляция активности изоцитратдегидрогензы, фосфофруктокиназы и др. ; 4. Процессы синтеза ВЖК и ацетилхолина и т. д.

• Содержание α-кетоглутарата в печени на начальных этапах ожоговой болезни увеличивается. Причина – интенсификация его образования из различных источников (глутаминовой кислоты, аргинина и др. ), а также нарушение процессов его дальнейшего окисления (т. к. снижается активность α- кетоглутаратдегидрогеназы).

• В ранние периоды ожоговой болезни снижается содержание оксалоацетата (ЩУК) в результате снижения активности митохондриальной малатдегидрогеназы. Вследствие этого снимается его ингибирующее влияние на сукцинатдегидрогеназную реакцию. При этом снижается интенсивность малатдегидрогеназной реакции в печени, в то время как активность цитоплазматической малатдегидрогеназы повышается. Это обеспечивает возможность накопления яблочной кислоты, играющей важную роль в поддержании достаточной концентрации сукцината.

Метаболические превращения пирувата в печени при ожоговой болезни. • Содержание ПВК в ранние стадии ожоговой болезни повышено. Это объясняется нарушением окислительного декарбоксилирования, что подтверждает уменьшение потребления кислорода митохондриями печени. В связи с такими изменениями у ожоговых больных часто имеется гиперпируватемия. Кроме того, это является важным фактором в развитии недостаточности энергообразования.

• Ограничение окислительного декарбоксилирования пирувата приводит к утилизации его по другим метаболическим путям, в частности в ходе лактатдегидрогеназной реакции. • Причины снижения интенсивности окислительных превращений пирувата в печени: 1. Уменьшение содержания витамина В в печени; 2. Преобладание восстановленных форм НАДН+Н над окисленными формами; 3. Изменения компонентов пируватдегидрогеназного комплекса (таких как HS-Ко. А, липоата и др. ); 4. Повышение концентрации ацетил-Ко. А вследствие интенсификации липолитических процессов после термических повреждений.

Изменение водно-солевого обмена при ожоговой болезни • В период шока формируется ожоговый отек. Он связан с задержкой воды в организме. При этом снижается количество выделяемой мочи (диурез равен 0, 85 мл/мин). Моча гипертоническая, с высокой осмотической концентрацией при снижении осмотической концентрации сыворотки крови (антидиуретическая активность).

• Во втором периоде болезни происходит повышение диуреза до 1, 71 мл/мин, осмолярность мочи снижается, а показатель осмолярности сыворотки крови остается пониженным. • В периоде септикотоксемии происходит нормализация осмотических сдвигов: осмотическое давление сыворотки ↑, диурез ↑, осмолярность мочи ↓. • В период реконвалесценции основные осмотические показатели постепенно возвращаются к норме.

• При ожоговой болезни нарушается баланс различных ионов. Кальций. Содержание ионов в крови в первое время понижено, затем повышается. Фосфор. Концентрация ионов увеличена в течение всего периода болезни. Причина – нарушение процессов окислительного фосфорилирования, изменение энергетического и других обменных процессов, а также распад поврежденных ожогом тканей.

Магний. Баланс ионов в первое время отрицателен, т. к. происходит повышение их экскреции с калом, мочой и экссудатом. Натрий. В стадии шока и ожоговой токсемии происходит значительное снижение выделения натрия и его задержка в организме. В период септикотоксемии баланс натрия становится отрицательным. Нормализация содержания ионов – в период выздоровления.

Калий. В трех первых периодах болезни сохраняется отрицательный баланс ионов калия в результате резкого увеличения почечной экскреции этого иона. Положительным баланс становится только после очищения раны от струпа.

• Основной причиной нарушения баланса ионов в организме ожогового больного в первые периоды болезни является изменение проницаемости биомембран. Так, при ожоговой болезни нарушаются процессы пассивного и активного транспорта ионов натрия и калия через эритроцитарные мембраны.

• Пассивная проницаемость мембраны эритроцитов для ионов натрия резко возрастает. Вследствие этого в термически поврежденную клетку устремляется больше ионов натрия, чем выходит ионов калия. Поэтому возникает гипотония внеклеточной жидкости и в поврежденные клетки устремляется вода. Формируется ожоговый отек.

• Чтобы избежать набухания и разрыва мембраны эритроцитов необходимо откачивать ионы путем активного транспорта с помощью фермента Na-K-АТФ-азы. Повышение АТФ-азной активности приводит к снижению уровня АТФ к клетках. Поэтому гидролиз АТФ, обеспечивающий энергией процессы активного транспорта ионов натрия из клетки в межклеточное пространство, при ожоговой болезни не может осуществляться в полной мере. Работа натриевого насоса нарушается, он не успевает откачивать натрий из клетки, в результате чего жизнедеятельность эритроцитов нарушается.

Влияние ожоговой травмы на эритроциты • Дефицит эритроцитарной массы проявляет себя на третьи сутки после ожога снижением числа эритроцитов и содержания гемоглобина. Развивающаяся анемия носит гемолитический характер. • В дальнейшем, в течение всего времени существования гнойно-некротической ожоговой раны наблюдается стойкая клиническая картина малокровия, носящая наиболее выраженный характер у пациентов с обширными (более 10%поверхности тела) глубокими ожогами.

• В период реконвалесценции полное восстановление количественных параметров красной крови отмечается не всегда. • Снижение жизнеспособности эритроцитов обусловлено комплексом изменений их структурных, метаболический и функциональных свойств. При этом в эритроцитах значительно уменьшается концентрация тиоловых соединений и липопротеидов.

• Происходит увеличение доли эритроцитов с пониженным и низким содержанием этих субстратов, а также в кровеносном русле появляются форменные элементы с предельно низкой концентрацией тиоловых групп и липопротеинового комплекса, не встречающиеся в периферической крови здоровых людей. Все эти изменения приводят к сокращению периода циркуляции эритроцитов в кровеносном русле.

• Эти преобразования происходят в результате активации комплекса патологических факторов воздействия термического агента. В частности, характерны активация протеолиза, липопероксидация, инициация эндогенных фосфолипаз и др. Они усугубляют обусловленное основными процессами гипоксическое состояние.

• В более поздние периоды болезни отмеченные нарушения сохраняются. Даже через 2 месяца после ожога выявляются отчетливые признаки структурно-метаболической дестабилизации циркулирующих эритроцитов, связанной с недостаточностью тиоловых групп и уровня липопротеидов, со снижением осмотической резистентности, с увеличением количества дегенеративно- измененных форм клеток, с изменением поверхностной и внутриклеточной ультраструктуры красных кровяных клеток.

Лабораторная диагностика • ОАК: -общий белок крови; -липидный спектр (ТГЦ, ЛПОНП, ЛПНП, свободные ЖК); -глюкоза; -электролиты; -кислотно-щелочное состояние. • ОАМ: -белок; -глюкоза; -осмолярность.

Термическая травма – это не просто локальное повреждение, она вызывает целый комплекс реакций во всем организме, называемый ожоговой болезнью. Прогрессирование изменений в организме опасно. Возможно развитие осложнений или смерть ожогового больного(ожоговое истощение, дистрофия печени, присоединение сепсиса и др. ).
Источник
Системные осложнения после ожогов
Чем больше площадь ожога, тем выше риск системных осложнений. К факторам риска как осложнений, так и летального исхода относят ожоги >40 % площади поверхности тела, возраст >60 лет или
Наиболее характерные системные осложнения – гиповолемия и инфекция. Ги-поволемия, приводя к недостаточному кровоснабжению обожженных тканей и иногда к шоку, может быть следствием потери жидкости с поверхности глубоких и обширных ожогов. Гипоперфузия обожженных тканей также может быть следствием прямого повреждения кровеносных сосудов или сосудистого спазма, вторичной гиповолемии. Инфекция, даже при небольших ожогах, часто становится причиной сепсиса и летального исхода, также как и местных осложнений. Нарушение защитных реакций организма и девитапизация тканей усиливает инвазию бактерий и их рост. В первые несколько суток наиболее часто встречаются стрептококки и стафилококки, в следующие 5-7 сут – грамотрицательные бактерии; но практически во всех случаях выявляют смешанную флору.
Метаболические нарушения могут включать гипоальбуминемию, возникающую, отчасти, из-за гемодилюции (вследствие возмещения жидкости), частично из-за перехода белка во внесосудистое пространство через поврежденные капилляры. Гипоальбуминемия и гемодилюция способствуют гипокальциемии, но концентрация ионизированного кальция обычно остается в пределах нормы. Возможен дефицит и других электролитов, а именно дилюционная гипомагниемия, гипофосфатемия и, особенно у пациентов, принимающих калийвыводящие диуретики, гипокалиемия. Обширное разрушение тканей может привести к гиперкалиемии. Метаболический ацидоз может быть следствием шока. Рабдомиолиз и гемолиз развиваются в результате глубоких термических и электрических ожогов мышц или ишемии мышечной ткани из-за сокращения струпа. Рабдомиолиз вызывает миоглобинурию, а гемолиз – гемоглобинурию, что в итоге может привести к острому канальцевому некрозу.
Гипотермия может развиться после внутривенного введения большого количества охлажденной жидкости, и под действием прохладного воздуха и предметов в отделении неотложной помощи на непокрытые части тела, особенно с обширными ожогами. На фоне электролитных нарушений, шока, метаболического ацидоза, иногда гипотермии, а также у пациентов с ингаляционными поражениями, вторично могут возникнуть желудочковые аритмии. После обширных ожогов характерно развитие кишечной непроходимости.
Местные осложнения после ожогов
Циркулярные ожоги конечности III степени приводят к формированию стягивающих струпов, которые могут способствовать развитию местной ишемии, а в области грудной клетки – к респираторным нарушениям.
Спонтанное заживление глубоких ожогов приводит к чрезмерному образованию грануляционной ткани, вызывая в дальнейшем рубцевание и контрактуры; если ожог располагается вблизи сустава или на кисти, стопе или промежности, это может привести к серьезным функциональным нарушениям. Инфекции могут стимулировать процесс рубцевания. Келоидные рубцы формируются только у некоторых групп пациентов, особенно у представителей черной расы.
Источник
