Более сильный термический ожог может быть вызван кипящим сахарным сиропом
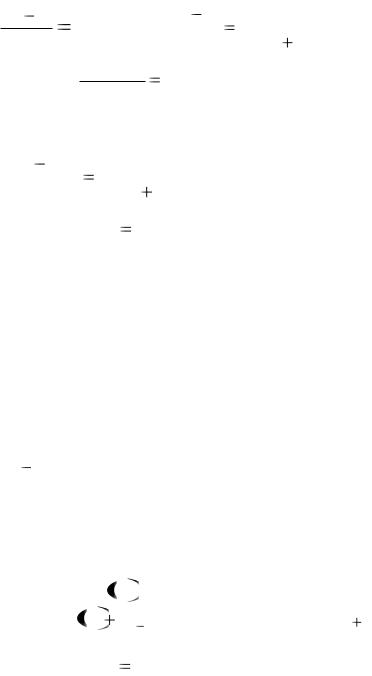

Добавил:
Upload
Опубликованный материал нарушает ваши авторские права? Сообщите нам.
Вуз:
Предмет:
Файл:
Скачиваний:
1725
Добавлен:
21.05.2015
Размер:
4.47 Mб
Скачать
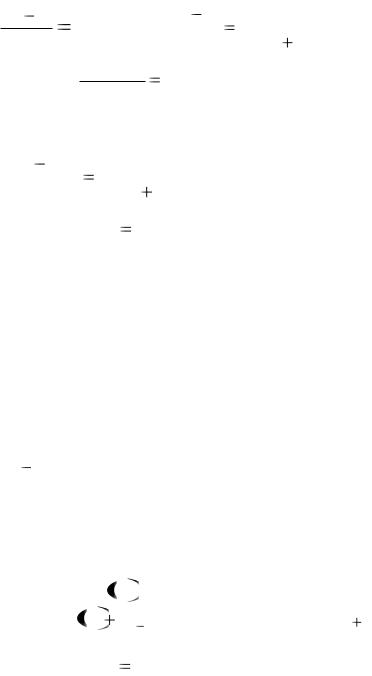
туры кипения помещѐнной в него воды, поэтому в этом случае вода закипит.
Задача № 4
Давление насыщенного пара над раствором, содержащим 5,2 г некоторого вещества в 117 г воды, равно при 70оС 307 кПа (р). Давление насыщенного пара над водой при той же температуре равно 312 кПа (ро). Определите молярную массу вещества.
Решение:
Согласно I закону Рауля
Ро Р | n(X) | ; | ||
P | n(X) n(Н | О) | ||
o | 2 | |||
117 г | = 6,5 моль. | |||
18 г/моль | ||||
Подставим данные в математическое выражение I закона Рауля и вычис-
лим n(X):
312 307 | n(X) | ||||||
; отсюда n(X) = 0,106 моль, соответственно, | |||||||
312 | n(X) 6,5 | ||||||
М(Х) = | m(Х) | 5,2 г | = 49 г/моль. | ||||
M (Х) | 0,106 моль | ||||||
Ответ: М(Х) = 49 г/моль.
Задача № 5
Вычислите давление насыщенного пара над раствором, содержащим 6,4 г нафталина (С10Н8) в 90 г бензола (С6Н6) при 20оС. Давление насыщенного пара над бензолом при данной температуре 9953,82 Па.
Решение:
По I-му закону Рауля относительное понижение давления насыщенного пара над раствором равно молярной доле растворенного вещества:
Po
где Ро – давление насыщенного пара над растворителем; Р – давление насыщенного пара над раствором;
N(X) – молярная доля вещества (Х), которая определяется по формуле:
n X | n(С10 | Н8 ) | ||||||||
N(X) = n X | nр ля ; | N(С10Н8) = | ; | |||||||
n(С Н | ) | n(С Н ) | ||||||||
10 | 8 | 6 | 6 | |||||||
n(C10Н8) = | m | 6,4 г | = 0,05 | моль; | ||||||
M | 128 г/моль | |||||||||
n(C6Н6) = | 90 г | = 1,15 моль; | ||||||||
78 г/моль | ||||||||||
30

N(С10Н8) = | 0,05 | 0,042; | |||||
1,15 0,05 | |||||||
Po | P | = 0,042; | 9953,82 Р | = 0,042; Р = 9521 Па Ро. | |||
Po | 9953,82 | ||||||
Давление насыщенного пара над раствором всегда меньше, чем над чистым растворителем.
Ответ: давление насыщенного пара над раствором равно 9521 Па.
Задача № 6
Вычислите температуру кипения и замерзания водного раствора фруктозы
( (С6Н12О6) = 5%).
Решение:
По II-му закону Рауля:
Ткип. = Е(Н2О) сm(X); Тзам. = K(Н2О) сm(X),
где Ткип – повышение температуры кипения раствора; Тзам – понижение температуры замерзания раствора;
Е(Н2О) – эбулиоскопическая константа для воды, справочная величина, равна 0,52 град кг/моль;
K(Н2О) – криоскопическая константа для воды, справочная величина, равна 1,86 град кг/моль;
сm(X) – моляльная концентрация вещества (Х).
сm(X) = | ω(X) 1000 | ; |
(100 ω(X)) M (X) |
5 1000
сm(С6Н12О6) = (100 5) 180 = 0,29 моль/кг;
Ткип = 0,52 град кг/моль  0,29 моль/кг = 0,15 град. tкип = 100оС + 0,15оС = 100,15оС.
0,29 моль/кг = 0,15 град. tкип = 100оС + 0,15оС = 100,15оС.
Тзам =1,86 град кг/моль  0,29 моль/кг = 0,54 град. tзам = 0оС 0,54оС = 0,54оС
0,29 моль/кг = 0,54 град. tзам = 0оС 0,54оС = 0,54оС
Ответ: 5%-ный раствор фруктозы закипит при 100,15оС, а замерзнет при
–0,54оС.
Задача № 7
Рассчитайте молярную массу неэлектролита, если его массовая доля в водном растворе 1,96%, а раствор замерзает при – 0,248оС.
Решение:
По II-му закону Рауля Тзам = K сm(Х),
где Kкр – криоскопическая константа воды, равная 1,86 град/(кг моль), сm(Х) – моляльная концентрация неэлектролита;
31

сm(Х) = | Tзам | 0,248 | 0,133 моль/кг . | |
Kкр | 1,86 | |||
По условию задачи в 100 г раствора содержится 1,96 г неэлектролита в
98,04 г воды:
сm(Х) = | m(X) | М(Х) = | m(X) | 1,96 | 150,4 г/моль . |
c | Х m | 0,133 0,098 | |||
M (X) mр | ля | m | р-ля | ||
Ответ: молярная масса неэлектролита равна 150,4 г/моль
Задача № 8
Определите, из скольких атомов состоит молекула серы, если температура кипения раствора 4,455 г серы в 50 г бензола на 0,905оС выше температуры кипения чистого бензола. (Е(С6Н6) = 2,60 град кг/моль)
Решение:
Согласно II закону Рауля:
Ткип. = Е(С6Н6) сm(SХ) или
Ткип. = Е(С6 | Н6 ) | m(SX ) 1000 | , отсюда | ||||||||||||
M (S | X | ) m(С | Н | ) | |||||||||||
6 | 6 | ||||||||||||||
М(SX). = | Е(С6Н6 ) m(SX ) 1000 | ; | |||||||||||||
Ткип. m(С6Н6 ) | |||||||||||||||
М(SX). = | 2,60 град кг/моль | 4,455 г 1000 | 256 г/моль ; | ||||||||||||
0,905 град 50 г | |||||||||||||||
х = | М (SX ) | 256 | 8 . | ||||||||||||
M (S) | 32 | ||||||||||||||
Ответ: Молекула серы состоит из 8 атомов.
Задача № 9
Температура замерзания 10%-ного водного раствора серной кислоты равна –5,5оС. Вычислите степень ионизации кислоты в этом растворе.
(K(Н2О) = 1,86 град кг/моль)
Решение:
Согласно II закону Рауля: Тзам. = i K сm(H2SO4). Рассчитаем сm(H2SO4) по формуле:
сm(H2SO4) = | ω(H2SO4) 1000 | ; | ||
(100 | ω(H2SO4)) M (H2SO4) | |||
сm(H2SO4) = | 10 1000 | = 1,134 моль/кг; | ||
(100 | 10) 98 | |||
tзам = tзам.(Н2О) – tзам.(р-ра) = 0 – (–5,5) = 5,5оС.
tзам = Тзам .
32

= 0,804 или 80,4%.
i = | Тзам. | 5,5 | 2,608 . | ||
K c | m | (H SO | ) | 1,86 1,134 | |
2 4 | |||||
i 1
= n 1 , где n – число ионов, образующихся при диссоциации H2SO4.
= 2,608 1 3 1
Ответ: = 80,4%.
Задача № 10
Раствор, содержащий 0,85 г хлорида цинка в 125 г воды, кристаллизуется при – 0,23оС. Рассчитайте кажущуюся степень диссоциации хлорида цинка в данном растворе.
Решение:
Моляльная концентрация соли в растворе равна:
сm (ZnCl2) = 0,85 г/136 г/моль 0,125 кг = 0,05 моль/кг;
По закону Рауля понижение температуры кристаллизации без учета диссоциации электролита составляет:
Ткр = Kкр сm = 1,86 град/кг моль 0,05 моль/кг = 0,093 град.
Сравнивая найденное значение с экспериментально определенным понижением температуры кристаллизации, определяем изотонический коэффициент i:
i = Ткр.эксп. / Ткр.выч. = 0,23/0,093 = 2,47.
Зная изотонический коэффициент, можно найти кажущуюся степень диссоциации соли:
i | 1 | 2,47 | 1 | 0,735 | |
= n | 1 | 3 | 1 | ||
Ответ: = 0,735
Задача № 11
Какую массу сахарозы следует растворить в 250 г воды, чтобы получить раствор, кипящий при 100,2оС ?
Решение:
По II-му закону Рауля Ткип = Е сm(Х),
где Е – эбулиоскопическая константа воды, равная 0,52 град кг/моль, сm – моляльная концентрация неэлектролита сахарозы.
По условию Ткип = 100,2 – 100 = 0,2 град;
сm = | Tкип | 0,2 | 0,385 моль/кг ; |
Kэб | 0,52 | ||
33

сm(С12Н22О11) = | m(X) |
M (X) mр ля | |
m(сахарозы) = 0,385 моль/кг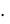 342 г/моль
342 г/моль 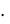 0,25 кг = 32,9 г
0,25 кг = 32,9 г
Ответ: m(сахарозы) = 32,9 г
Задача № 12
Какова массовая доля глицерина в водном растворе, если он замерзает при
–0,52оС?
Решение:
Понижение температуры замерзания раствора
Тзам. = Тзам. р-ля Тзам. р-ра 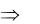 Тзам. = 0оС ( 0,52оС) = 0,52оС.
Тзам. = 0оС ( 0,52оС) = 0,52оС.
По II-му закону Рауля Тзам = K(Н2О)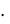 сm(Х), тогда
сm(Х), тогда
cm = | Tзам | 0,52 град | = 0,28 моль/кг. |
K (H2O) | 1,86 кг град/моль | ||
Переход от моляльной концентрации к массовой доле осуществляется по формуле:
сm(Х) = | 1000 | = | cm (X) | (100 | ω) | M (X) | ; | |||||||
(100 | ω) | M (X) | 1000 | |||||||||||
0,28 (100 | ) 92 | 25,76 (100 ) | ; | |||||||||||
1000 | 1000 | |||||||||||||
= | 2576 25,76 | ; | 1000 | = 2576 – 25,76 | ; | = 2,51%. | ||||||||
1000 | ||||||||||||||
Ответ: массовая доля глицерина в водном растворе 2,51%.
Задача № 13
Рассчитайте осмотическое давление при 310 К 20%-ного водного раствора глюкозы ( = 1,08 г/мл), применяемого для внутривенного введения, например, при отеке легкого. Каким будет этот раствор (гипо-, гипер-, изотоническим) по отношению к крови, если учесть, что Росм крови равно
740–780 кПа?
Решение:
По закону Вант-Гоффа: Росм = с(Х)RT,
где с(Х) – молярная концентрация раствора; R –газовая постоянная, 8,31 Дж/(моль К); Т – абсолютная температура.
Переход от массовой доли к молярной концентрации осуществляется по формуле:
c(X) | ω ρ 10 | ; с(С6Н12О6) = | 20 1,08 10 | = 1,2 моль/л. |
M (X) | 180 | |||
Росм=1,2 103 моль/м3  8,31 Дж/моль 310 К = 3 091 320 Па = 3091,3 кПа.
8,31 Дж/моль 310 К = 3 091 320 Па = 3091,3 кПа.
34

Ответ: так как 3091,3 кПа Росм крови, то 20%-ный раствор глюкозы является гипертоническим.
Задача № 14
Что произойдет с эритроцитами при 310 К в 2%-ном растворе глюкозы
( = 1,006 г/мл)?
Решение:
Эритроциты в гипотонических растворах за счет эндоосмоса лопаются, происходит гемолиз, а в гипертонических растворах – сморщиваются (плазмолиз).
Осмотическое давление 2%-ного раствора глюкозы определяется по закону Вант-Гоффа:
Росм. = с(Х)RT, где c(X) | ω ρ 10 | ; | |||||
M (X) | |||||||
Pосм. | ω С6Н12О6 | ρ 10 | R Т | ||||
M С6Н12 | О6 | ||||||
Росм. | = | 2 1,006 10 | 103 моль/м3 8,31 Дж/(моль К) 310 К = 287951 Па = | ||||
180 | |||||||
287,951 кПа
Ответ: Росм 2%-ного раствора глюкозы меньше осмотического давления крови, поэтому с эритроцитами в таком растворе произойдет гемолиз.
Задача № 15
Осмотическое давление крови равно в норме 740-780 кПа. Вычислите осмолярность крови при 310 К.
Решение:
По уравнению Вант-Гоффа: Росм = с(Х) R T.
Pосм.
сосм(Х) = R  T ,
T ,
где сосм – осмолярная концентрация – это суммарное молярное количество всех кинетически активных, т.е. способных к самостоятельному движению, частиц, содержащихся в 1 литре раствора, независимо от их формы, размера и природы.
сосм1 | = | 740000 Па | = 287,3 моль/м3 | = 0,287 осмоль/л; |
8,31 Дж/моль К 310 К | ||||
сосм2 | = | 780000 Па | = 302,8 моль/м3 | 0,303 осмоль/л. |
8,31 Дж/моль К 310 К
Ответ: осмолярность крови составляет 0,287–0,303 осмоль/л.
Задача № 16
35

При несахарном диабете выделяются большие объемы разбавленной мочи, осмолярность которой снижается до 0,06 осмоль/л. Вычислите осмотическое давление такой мочи при 310 К.
Решение:
Росм = с(Х) R T = 0,06 103 осмоль/м3  8,31 Дж/моль К
8,31 Дж/моль К  310 К=154566 Па = = 154,6 кПа.
310 К=154566 Па = = 154,6 кПа.
Ответ: осмотическое давление разбавленной мочи значительно ниже осмотического давления плазмы крови.
Задача № 17
Рассчитайте осмотическое давление 0,01 М раствора KCl, при Т = 310 К, если изотонический коэффициент (i) равен 1,96. Каким будет этот раствор по отношению к плазме крови?
Решение:
Для растворов электролитов в уравнение Вант-Гоффа вводится изотонический коэффициент (i) для учета электролитической диссоциации:
Росм = i с(Х) R T
Росм = 1,96 с(KCl) R T = 1,96 0,01 103 моль/м3 8,31 Дж/моль К 310 К = 50491,56 Па = 50,5 кПа.
Ответ: 0,01 М раствор гипотоничен плазме крови.
Задача № 18
В качестве слабительного средства взрослым назначают принимать натощак 0,5 стакана(100 мл) раствора глауберовой соли, содержащего 20 г Na2SO4 10H2O. Рассчитайте осмотическое давление этого раствора при 25 С и поясните механизм его действия (i = 2,75).
Решение:
По закону Вант – Гоффа для растворов электролитов
Росм(Х) = i с(Х) R T= i | m(Na 2SO 4 | 10H 2O) 1000 | RT ; | ||
M (Na 2SO 4 | 10H 2O) Vp pa | ||||
Росм= 2,75 | 20 1000 8,314 298 | =4231,88 кПа. | |||
322 100 | |||||
Ответ: раствор гипертоничен, т.к. его Росм больше 760 кПа, поэтому осмотическое давление в просвете кишечника повышается, вызывая тем самым поступление большого количества воды и послабляющее действие.
Задача № 19
При внутренних кровоизлияниях (легочных, желудочно-кишечных), а также для усиления диуреза внутривенно вводят от 5 до 20 мл 10%-ного раствора NaCl ( = 1,071 г/мл, i = 1,87). Рассчитайте осмотическое давле-
36

ние этого раствора и определите, каким он будет по отношению к плазме крови. (t = 37 С).
Решение:
с(NaCl) | 10 | 10 1,071 10 | = 1,83 моль/л | |
М | 58,5 | |||
Росм = iсRT = 1,87 1,83 8,314 310 = 8819,92 кПа
Ответ: раствор будет гипертоничен по отношению к плазме крови.
Задача № 20
Какова степень электролитической диссоциации ( ) дихлоруксусной кислоты в ее 0,01 М растворе, если при 300 К этот раствор создает осмотическое давление в 43596,4 Па?
Решение:
Так как СНСl2СООН – электролит, используется уравнение Вант-Гоффа в виде: Росм = i с(Х) R T.
Из этого уравнения i | с(X) R T ; | ||||||
Pосм | |||||||
i | 43596,4 Па | = 1,75. | |||||
0,01 103 моль/м3 | 8,31 Дж/моль К 300 К | ||||||
Степень диссоциации электролита определяется по формуле: | i | 1 | , | ||||
n | 1 | ||||||
где i – изотонический коэффициент;
n – число ионов, на которое распадается данный электролит;
1,75 1 = 0,75.
2 1
Ответ: степень диссоциации дихлоруксусной кислоты равна 0,75.
 Обучающие тесты
Обучающие тесты
1.Более сильный термический ожог может быть вызван кипящим сахарным сиропом с массовой долей сахарозы, равной:
1) 2% 2) 5% 3) 8% 4) 10%
Решение:
Согласно II закону Рауля повышение температуры кипения раствора по сравнению с растворителем рассчитывается по формуле:
Ткип = Е сm(Х),
где сm(Х)-моляльная концентрация растворѐнного вещества.
Между моляльной концентрацией и массовой долей существует математическая зависимость, из которой видно, что чем больше массовая доля
37

растворѐнного вещества, тем больше и моляльная концентрация этого вещества в растворе
сm(Х) = | 1000 |
(100 ω) M (X) . | |
Таким образом, самую высокую температуру кипения будет иметь раствор с массовой долей сахарозы, равной 10%, следовательно, этим раствром можно получить более сильный термический ожог.
Ответ: 4
2.Осмотическое давление сантимолярного раствора АlCl3 по сравнению с сантимолярным раствором NaCl будет ____________.
Решение:
NaCl и АlCl3 – электролиты, поэтому осмотическое давление растворов этих веществ рассчитывается по формуле
Росм = i с(Х) R T.
Между изотоническим коэффициентом i и степенью диссоциации существует математическая взаимосвязь: i = 1+ (n–1),
где n-число ионов, образующихся при диссоциации электролита.
Для АlCl3 n = 4, для NaCl n = 2, а т.к. эти вещества – сильные электролиты, то для них можно условно принять, что величина равна 100%.
С учѐтом этого очевидно, что i(АlCl3) > i(NaCl), следовательно,
Росм(АlCl3) > Росм (NaCl).
Ответ: больше.
3.В закрытом сосуде находятся 2 стакана: с чистой водой (1) и с водным раствором сахара (2). Через некоторое время:
1)уровень жидкости в стакане (1) понизится, в стакане (2) повысится
2)уровень жидкости в стакане (1) повысится, в стакане (2) понизится
3)уровень жидкости в обоих стаканах не изменится
4)уровень жидкости в обоих стаканах понизится
Решение:
Так как давление насыщенного пара растворителя над водным раствором сахара согласно I закону Рауля ниже, чем над чистой водой, то в закрытом сосуде будет происходить диффузия молекул паров воды от стакана с чистой водой к стакану с водным раствором сахара. В результате этого:
а) давление пара растворителя над стаканом с чистой водой уменьшится, равновесие нарушится, поэтому в соответствии с принципом Ле Шателье скорость испарения станет больше скорости конденсации, что приведѐт к уменьшению уровня жидкости в стакане с чистой водой; б) давление пара растворителя над стаканом с водным раствором сахара
увеличится, равновесие нарушится, поэтому в соответствии с принципом
38

Ле Шателье скорость конденсации станет больше скорости испарения, что приведѐт к увеличению уровня жидкости в стакане с водным раствором сахара.
Ответ: 1.
4.Меняется ли температура кипения раствора и чистого растворителя в процессе их кипения?
1)tкип растворителя не меняется, tкип раствора повышается
2)tкип растворителя и раствора повышаются
3)tкип растворителя повышается, tкип раствора не меняется
4)tкип растворителя не меняется, tкип раствора понижается
Решение:
Температура кипения растворителя не меняется, так как подводимое к не-
му тепло тратится на эндотермический процесс испарения. Температура кипения раствора будет постепенно повышаться, так как в результате испарения растворителя моляльная концентрация растворенного вещества увеличивается и в соответствии со II законом Рауля ( Tкип = iEcm(X)) температура кипения будет возрастать.
Ответ: 1
5.В месте воспаления осмотическое давление _________ , поэтому рану нужно обрабатывать __________ раствором, чтобы вызвать ________
бактерий и микроорганизмов.
Решение:
В месте воспаления в результате повышенного местного обмена веществ усиливается распад макромолекул на более мелкие фрагменты, в результате чего увеличивается количество частиц и, соответственно, осмотическое давление. По этой же причине рану нужно обрабатывать гипертоническим раствором, чтобы вызвать плазмолиз микроорганизмов и бактерий, а также отток (экзосмос) жидкости из раны в гипертонический раствор, что способствует ее очищению.
Ответ: … увеличивается … гипертоническим … плазмолиз.

 Задачи и упражнения для самостоятельного решения
Задачи и упражнения для самостоятельного решения
1.Являются ли изотоническими: а) 5%-ные растворы глюкозы и фруктозы; б)5%-ные растворы глюкозы и сахарозы; в) 0,01М растворы глюкозы и хлорида натрия?
2.Зачем посыпают солью дороги зимой? Является ли солѐным лѐд на берегу северных морей?
3.Рассчитайте молярную массу неэлектролита, если 28,5 г этого вещества, растворенного в 785 г воды, вызывают понижение давления пара
39
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Термические ожоги характеризуются покраснением, отеком, гиперемией кожи, появлением пузырей, в более сложных стадиях поражается ткань, мышцы, иногда внутренние органы. Причиной таких поражений часто является человеческая невнимательность или несчастный случай.
В не зависимости от стадии термического ожога больной нуждается в оказании ему первой помощи. При 1 и 2 стадиях потерпевший может проводить лечение в домашних условиях, 3 и 4 стадии относятся к наиболее тяжелым — человек нуждается в госпитализации и лечении в стационаре.
Термические ожоги 1, 2 и 3 степени
Термические ожоги возникают при действии на кожу высоких температур, источниками которой могут быть:
- твердые, раскаленные предметы, в том числе, кухонная посуда;
- открытое пламя из любого источника, от газовой горелки до обыкновенной спички;
- горячая вода из любого источника, включая природные ручьи;
- пар из трубы или шланга на производстве, обогревательных приборов, домашней посуды.
Ориентировочно все ожоги условно делят на необширные – поражено до 10% тела, и обширные – свыше 10%. Исходной величиной в данном случае принято считать площадь ладони потерпевшего, которая равняется 1% общей площади тела. Так с помощью ладони можно определить, сколько процентов тела поражено ожогом.
- Необширные ожоги вызывают общую болевую реакцию, иногда с повышением температуры и головной болью, чувством дискомфорта и болезненности в области повреждения;
- При обширных поражениях наблюдаются более серьезные осложнения и нарушения в работе всего организма — ожоговая болезнь.
В зависимости от степени проникновения ожога на определенную глубину и область поражения кожи, выделяют четыре основные степени повреждений. Степень ожога выражается в процентном отношении, которое указывает на площадь поражения кожи.
- 4 степень. Ожоги охватывают всю площадь, и происходит омертвление большей части тканей. Есть риск вероятности смертельного исхода.
- 3 степень отличается поражением тканей до мышц, а иногда и до костей, при этом пузыри, чаще всего, лопнувшие, формируется струп. Поражённый участок может быть окружен зоной ожога II степени с мелкими пузырями, заполненными прозрачной жидкостью, а также покрасневшей кожей (первая степень).
- 2 степень выражается в покраснении и отёке кожи, наряженных или лопнувших пузырях, а также формирующемся со временем тонком струпе.
- 1 степень. Пораженное место постепенно опухает и краснеет. В это время человек испытывает боль и жжение в области пораженной ткани. Симптоматика проявляется в течение 2-3 дней, а потом исчезает. Примерно через неделю кожа выглядит полностью здоровой.
Разумеется, степень ожога будет зависеть от многих факторов, к примеру, от длительности воздействия высокой температуры. А неправильно оказанная помощь при термических ожогах может повлечь за собой дополнительные травмы при удалении одежды или предмета, вызвавшего ожог. Поэтому очень важно знать правила первой медицинской помощи при термических ожогах.
Первая помощь при термических ожогах
Для того чтобы оказать первую помощь в домашних условиях, необходимо провести ряд процедур, направленных на устранение болевых ощущений у человека и предотвращение заражения поврежденного участка кожи:
- Немедленно погасить пламя на одежде и коже пострадавшего, для чего накрыть его тканью (это приведет к прекращению поступления воздуха), или сбросить горящую одежду. Можно погасить пылающий участок одежды, забросав его землей, песком или снегом, облив водой или опустив в воду.
- Успокоить пострадавшего и окружающих, таким образом предотвратив приступы паники у обеих сторон.
- Осторожно снять с пострадавшего тлеющие остатки одежды, которые не зафиксировались в ране. Запрещено отдирать от раны прилипшие остатки одежды. Прикасаться к обожженной поверхности руками тоже нельзя.
- Пострадавшего лучше всего поместить в прохладное помещение или в тень, если ожог произошел летом на улице. Как можно подробнее необходимо выяснить обстоятельства, при которых человек получил повреждения.
- Держать в течение 15-20 минут поврежденную поверхность под проточной холодной водой – это поможет улучшить кровообращение и не даст пораженному участку увеличиться в размерах за счет нагревания оставшихся участков кожи (только при ожогах 1-2 степени).
- Нельзя применять для охлаждения зоны ожога лед, так как, помимо имеющегося ожога, у пострадавшего возникнет дополнительная травма – обморожение.
- Использовать для нанесения на пострадавший участок кожи противоожоговое средство (например “Спасатель” или “Пантенол”) и наложить сухую стерильную повязку. При обширных ожогах конечностей, можно аккуратно зафиксировать их с помощью наложения шины.
- При обширных ожогах и при возникновении признаков ожогового шока (бледность, слабость, беспокойство, холодный пот, тахикардия, падение артериального давления, нарушение сердечной деятельности и дыхания) дать пострадавшему пить много жидкости – чистую воду, чай, компот.
- Если пострадавший жалуется на боли, то для того, чтобы избежать болевого шока, следует дать ему любое имеющееся обезболивающее средство (спазмалгон, анальгин и пр.).
- Если у человека отсутствует дыхание, в первую очередь нужно провести сердечно-легочную реанимацию, например искусственное дыхание или же непрямой массаж сердца.
- При показаниях для госпитализации вызвать «Скорую помощь» или доставить пострадавшего в лечебное учреждение.
При выполнении всех перечисленных условий шансы на благоприятный исход у пострадавшего довольно-таки высоки. Однако необходимо помнить, что даже самая маленькая и незначительная термическая травма может спровоцировать тяжелые последствия, в том числе и летальный исход у пострадавшего.
Лечение термического ожога в домашних условиях
Существуют некоторые ограничения по лечению термических ожогов в домашних условиях. Итак, можно не обращаться в больницу, если:
- степень термического ожога легкая (1-я или 2-я), без повреждений глубоких слоев кожи;
- ожог составляет около 1% размеров тела — площадь приблизительно равна размерам ладони;
- локализация ожога величиной с ладонь – не лицо, не стопа и не кисть;
- ожоговая рана не воспаляется, отсутствуют нагноения и покраснения краев раны.
Противошоковая терапия должна быть адекватна этапу оказания медпомощи, тяжести ожогового шока и возрасту пострадавшего. В неё должны входить следующие мероприятия:
- снятие боли;
- восполнение дефицита крови (её компонентов);
- профилактика, лечение гипоксии;
- коррекцию водно-электролитного, белкового обмена и кислотно-щелочного равновесия крови;
- борьбу с интоксикацией;
- компенсирование энергетических затрат организма;
- профилактику, лечение сердечных расстройств;
- профилактику, лечение острой печёночно-почечной недостаточности.
Большое внимание стоит уделить лечению ожогов у детей, поскольку нужно действовать не только быстро , но и максимально безопасно, случайно не нанеся вред ребенку. Эффективное лечение ожогов 3-й и 4-й степени во многом зависит от того, насколько быстро удается получить квалифицированную медицинскую помощь.
Что нельзя делать
- вскрывать волдыри;
- заклеивать рану пластырем;
- обрабатывать рану ватой – только стерильный бинт или марлевые тампоны;
- прикасаться к ране руками без стерильных перчаток;
- накладывать на рану какие-либо средства народной медицины (масло, сметану, кефир, взбитые яйца, спиртовые растворы любых целительных трав и т.д.).
Ожоговый шок
Это ответная реакция организма на сверхсильный болевой раздражитель. В основе его лежит термическая травма, приводящая к тяжелым расстройствам центральной, регионарной и периферической гемодинамики с преимущественным нарушением микроциркуляции и обменных процессов в организме обожженного; происходит централизация кровообращения. Длительное болевое раздражение приводит к нарушению функции центральной нервной системы, эндокринных желез и деятельности всех систем организма.
Прогноз
Все ожоги негативно сказываются на системных органах человека. Как быстро восстановится человек после ожога, зависит от его обширности, степени и возраста больного. Опасны ожоги для пожилых людей после 60 лет и маленьких деток.
Критическое состояние, если ожог поражает всю кожу, лицо, гениталии, промежность, внутренние органы. В данной ситуации человека редко спасают. Итак, воздействие тепла на кожу температуры больше 50 градусов приводит к тому, что клетки перегреваются, гибнут, происходит белковая денатурация, паралич в тканевом дыхании, нарушается метаболизм. Термический ожог – это опасно, поэтому нужно, как можно раньше принять меры.
Источник
